La demencia senil es un trastorno neurológico que padecen las personas de mayor edad. Afecta a escala mundial a alrededor de 30 millones de individuos, y por ello representa un importante problema social y sanitario que se ha ido incrementando a medida que se alarga la esperanza de vida, por lo que es predecible que pueda llegar a alcanzar una prevalencia de proporciones alarmantes en un futuro no muy lejano.
Las causas que producen este trastorno pueden ser numerosas, y por tanto el término «demencia senil» no comporta ninguna connotación neuropatológica o terapéutica. La etiología de este tipo de demencia incluiría:
• Enfermedades neurodegenerativas (enfermedad de Alzheimer).
• Demencias adquiridas y potencialmente reversibles: seudodemencia depresiva, causas metabólicas (tiroideas, hepáticas, desequilibrios iónicos...), toxicidad farmacológica, deficiencias nutricionales, alcoholismo, hidrocefalia, vasculitis, tumores (meningiomas), hematoma subdural crónico...
• Demencias vasculares: demencia multiinfarto (grandes vasos), estado lacunar, enfermedad de Binswanger.
• Demencias de origen infeccioso: enfermedad debida a priones no familiar, demencia del sida (por infecciones oportunistas asociadas al virus de la inmunodeficiencia humana), neurolúes, encefalitis...
Este capítulo se centrará en el tratamiento de la enfermedad de Alzheimer (EA), ya que esta enfermedad degenerativa es, con diferencia, la causa más frecuente de demencia senil.
La EA es un trastorno neurodegenerativo progresivo cuyo principal síntoma es la pérdida de memoria. Se caracteriza por una disminución cognitiva que repercute en la capacidad de llevar a cabo las actividades diarias, con alteraciones psicológicas y del comportamiento, además de trastornos del sueño, depresión, psicosis y agitación, lo cual conduce al paciente a un estado de incapacidad absoluta.
Tratamiento farmacológico tradicional
Para comprender mejor los grupos farmacológicos utilizados en el tratamiento de la EA, es necesario recordar los cambios importantes que se producen en el paciente desde el punto de vista neuroquímico:
• «Hipótesis colinérgica». A nivel colinérgico se produce una reducción de la actividad de colina acetiltransferasa (se reduce la síntesis de acetilcolina); también se reduce el número de neuronas colinérgicas en la EA tardía, y se produce una disminución de subtipos de receptores nicotínicos en el hipocampo y el córtex.
• Se incrementan las concentraciones de glutamato a nivel presináptico, y se produce hiperestimulación del receptor NMDA (N-metil-D-aspartato) que controla los canales iónicos.
Por ello, existen dos grupos de fármacos que son el tratamiento principal para la EA: los inhibidores de la acetilcolinesterasa, y los antagonistas de los receptores NMDA.
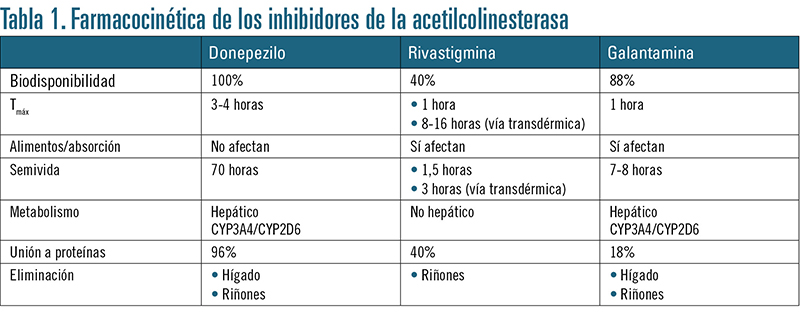 Inhibidores de la acetilcolinesterasa
Inhibidores de la acetilcolinesterasa
Estos fármacos actúan reduciendo la actividad de la enzima acetilcolinesterasa, y por tanto inhibiendo la degradación de la acetilcolina, lo que incrementa las concentraciones de la misma y el tiempo que ésta permanece en el lugar de la neurotransmisión. Hay tres fármacos de este grupo aprobados para el tratamiento de la EA en fase leve-moderada: donepezilo, rivastigmina y galantamina; no hay evidencia de las diferencias entre ellos en cuanto a eficacia (tabla 1):
• Donepezilo. Inhibe de forma selectiva y reversible la acetilcolinesterasa. Su absorción digestiva es muy rápida y su semivida prolongada, lo que permite que pueda administrarse una vez al día. La dosis inicial es de 5 mg/día y, después de 4 semanas de administración, puede incrementarse a 10 mg/día. Diversos estudios han demostrado la eficacia de este fármaco para mejorar el estado global clínico del paciente: concretamente mejora la cognición y la capacidad funcional, así como la calidad de vida.
• Rivastigmina. Es un inhibidor de doble acción: por un lado es capaz de inhibir de forma seudoirreversible la acetilcolinesterasa, y por otro también inhibe la butirilcolinesterasa. En el caso de su acción sobre la acetilcolinesterasa, inhibe de forma preferente la isoforma G1 de esta enzima, que está localizada sobre todo en el córtex y el hipocampo, mientras que el donepezilo y la galantamina no son selectivos de ninguna isoforma y por tanto potencian la actividad colinérgica en todo el sistema nervioso central y a nivel periférico. La actividad colinérgica que promueve la rivastigmina, en contraste con los otros fármacos del grupo, es más selectiva a nivel cerebral.
Este fármaco se absorbe bien por vía oral, su semivida es corta y se administra en dos dosis diarias. Las dosis orales iniciales suelen ser de 1,5-3 mg/día, dosis que se incrementan gradualmente hasta llegar a 6-12 mg/día. Puede administrarse también mediante parches transdérmicos, y en este caso la dosificación es inicialmente de 4,6 mg/día/5 cm2 hasta llegar a una dosis final de 9,5 mg/día/5 cm2.
La evidencia científica ha mostrado que la administración de rivastigmina mejora el estado clínico global en pacientes con EA leve-moderada. Puede emplearse también en demencias con parkinsonismo asociado.
• Galantamina. Es un fármaco con doble mecanismo de acción: es inhibidor selectivo, reversible y competitivo de la acetilcolinesterasa, pero además tiene acción como agonista de los receptores nicotínicos cerebrales, lo que potencia su acción sobre la acción colinérgica. La galantamina se absorbe bien por vía oral y se administra en dos dosis diarias, la dosis inicial es de 8 mg/día hasta llegar a una dosis final de 16-24 mg/día. Su eficacia ha sido demostrada en varios ensayos clínicos a gran escala; concretamente, provoca beneficios en la cognición y está indicada para la EA leve-moderada y en demencias mixtas (EA con enfermedad vasculocerebral).
La administración de estos fármacos se asocia a la aparición de efectos adversos resultantes de la estimulación colinérgica a nivel cerebral y periférico, que incluyen los siguientes: entre los más frecuentes, los de localización gastrointestinal al inicio del tratamiento o cuando se incrementa la dosis (náuseas, vómitos, diarrea y dolor abdominal, pérdida de apetito...); también alteraciones del sueño, mareos, cefaleas, calambres musculares y fatiga; poco frecuentes son la bradicardia, el bloqueo auriculoventricular (aunque es importante tenerlo en cuenta si se administran a pacientes con patologías cardiacas) y las convulsiones. Se recomienda iniciar el tratamiento con dosis bajas para reducir la aparición de los efectos adversos. En cuanto a las interacciones, los fármacos anticolinérgicos son antagonistas de estos anticolinesterásicos, por lo que no deberían administrarse simultáneamente. Por otra parte, también hay que vigilar la administración conjunta de inhibidores o inductores enzimáticos, ya que podrían aumentar las reacciones adversas o disminuir la acción de donepezilo y galantamina.
Antagonista NMDA
La memantina es un fármaco aprobado para el tratamiento de la EA moderada-grave, aunque también es útil en los casos de EA leve-moderada, en los pacientes que no toleren los inhibidores de la acetilcolinesterasa. Es un antagonista no competitivo del receptor NMDA, con moderada afinidad al mismo. Esta acción se considera que previene la neurotoxicidad debida a la persistente sobreestimulación de los receptores NMDA provocada por el glutamato, lo que parece tener una implicación relevante en la patogenia de la EA.
Se administra dos veces al día por vía oral, por donde tiene una buena absorción. Los alimentos no afectan a su absorción, y tiene una biodisponibilidad aproximadamente del 100%. La dosis inicial es de 5 mg/día y puede aumentarse a un máximo de 20 mg/día. Posee una semivida de 60-100 horas y el Tmáx es de 3-8 h. Alrededor del 45% se une a proteínas plasmáticas. Se metaboliza alrededor del 20%, formando metabolitos inactivos. Se elimina en su mayor parte por vía renal.
Sus efectos adversos más frecuentes son estreñimiento, hipertensión arterial, vértigo, cefaleas, somnolencia y disnea. Debido a sus efectos y su mecanismo de acción, debe evitarse la administración simultánea con otros antagonistas del receptor NMDA, como amantadina, ketamina y dextrometorfano. Los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento con memantina. Ésta puede reducir los efectos de barbitúricos y neurolépticos. Se recomienda precaución en los pacientes epilépticos o con enfermedad renal grave, y también en aquellos con infarto agudo de miocardio reciente, insuficiencia cardiaca grave o hipertensión arterial no controlada.
Su eficacia ha sido evaluada adecuadamente: la monoterapia con memantina ha demostrado un beneficio en la cognición a las 12 semanas, y en terapia combinada con el grupo de fármacos anterior se ha confirmado su beneficio por producirse acciones sinérgicas que mejoran la cognición, la funcionalidad, el estado clínico global y el comportamiento.
 Nuevas perspectivas y tendencias terapéuticas
Nuevas perspectivas y tendencias terapéuticas
Hay ciertos fármacos que han sido utilizados para el tratamiento de la demencia pero cuya eficacia no ha quedado totalmente demostrada y en los que el número de estudios resulta insuficiente. Entre estos fármacos destacan los siguientes:
• Nimodipino. Es un bloqueador de los canales del calcio, y ha sido investigado en diversos ensayos clínicos. Se considera que este fármaco puede tener efectos directos en el sistema nervioso central por un bloqueo de los canales neuronales del Ca2+ del tipo L, lo que resulta en una reducción de la entrada de Ca2+ a las neuronas. Además, la disponibilidad para el tejido neuronal es elevada debido al carácter lipofílico de este fármaco. Se ha utilizado de forma experimental para la demencia con afección vascular y demencia asociada al virus de la inmunodeficiencia humana (VIH). Estudios previos en animales han demostrado que mejora la capacidad de aprendizaje, el comportamiento exploratorio y las funciones sensomotoras de los animales viejos; por lo tanto, podría ser un fármaco interesante para el tratamiento de trastornos del sistema nervioso central relacionados con la vejez, aunque es necesario seguir investigando sus posibilidades.
• Piracetam. Se trata de un derivado cíclico del ácido gammaaminobutírico (GABA) que puede tener una acción en la estimulación de la memoria y de otras funciones intelectuales mediante mecanismos que no se han determinado; por eso se dice que es un estimulante de la cognición o nootrópico inespecífico. Se prescribe actualmente para el deterioro cognitivo y la demencia en varios países europeos, aunque la evidencia científica disponible en los estudios publicados no apoya su utilización. Se necesitan estudios adicionales para confirmarlo como un tratamiento eficaz.
• Melatonina. Esta hormona se sintetiza principalmente en la glándula pineal y desarrolla diversas funciones fisiológicas, entre ellas la regulación del ritmo circadiano, la eliminación de radicales libres, el incremento de la actividad inmunitaria y la inhibición de reacciones oxidativas, por lo que se considera que tiene una gran actividad antioxidante. Los niveles de melatonina se reducen con la edad y en los pacientes con EA, por ello se considera un posible fármaco para su tratamiento. Estudios preclínicos apoyan esta idea, pues han demostrado su capacidad antioxidante, su efecto sincronizador del ritmo sueño-vigilia, su capacidad antiinflamatoria en el sistema nervioso central, y su efecto inhibidor de la hiperfosforilación de la tau y de la formación de capas amiloideas; por ello, es importante que continúen realizándose estudios del desarrollo neuronal en presencia de melatonina.
• Inmunoglobulina intravenosa (IGIV). La formación de la proteína betaamiloide (A) contribuye a acelerar la EA, concretamente produce la reducción del volumen cerebral total y daños específicos en el hipocampo que provocan un déficit neurotransmisor. La IGIV produce una inmunoterapia que reconoce y bloquea la toxicidad de la proteína A. Tras los ensayos clínicos en humanos, la IGIV ha demostrado que puede detener el deterioro cognitivo provocado por el Alzheimer durante 3 años; incluso se ha visto que los pacientes aprenden cosas nuevas, lo cual es extraordinariamente infrecuente en estos enfermos. Actualmente se está realizando un estudio en fase III que terminará en marzo de 2015.
Además, en los últimos años se están desarrollando diversas vacunas que generan una respuesta inmunitaria frente a las proteínas amiloides, de forma que protegerían frente al Alzheimer; y no sólo podrían prevenir el daño cerebral, sino también recuperar la disfunción cognitiva. Otra estrategia en auge es el desarrollo de anticuerpos que se unen a las proteínas tóxicas en el cerebro para que las células inmunitarias las reconozcan y las ataquen.
Fitoterapia en pacientes con enfermedad de Alzheimer
Las propiedades farmacológicas de las plantas sobre las propiedades cognitivas no se han estudiado de forma exhaustiva en el contexto de los modelos actuales de EA. Una excepción es el Ginkgo biloba, pues numerosos estudios clínicos avalan la utilización del extracto de ginkgo en el tratamiento de la pérdida de memoria, la depresión y la desorientación asociada a la declinación cognitiva producida por la degeneración neuronal. Ensayos clínicos con otras plantas como Panax ginseng, Salvia officinalis y Melissa officinalis también han demostrado mejoras en la capacidad cognitiva de pacientes con EA.
 Ginkgo («Ginkgo biloba L»)
Ginkgo («Ginkgo biloba L»)
El ginkgo es un árbol de origen chino de la familia de las Ginkgoaceae que se caracteriza por tener un crecimiento muy lento. Existen documentos escritos que establecen la utilización de ginkgo desde hace 5.000 años en la cultura china. Se utilizan fundamentalmente las hojas, que se recolectan verdes, se estabilizan y se desecan para la posterior obtención del extracto. Los principios activos están constituidos por dos tipos de compuestos: flavonoides y terpenos. Los flavonoides (0,5-1%) son fundamentalmente heterósidos de flavonoles (O-glucósidos) y los terpenos son fundamentalmente diterpenos (ginkgólidos, 0,06-0,23%) y sesquiterpenos (bilobálido, 0,4%). Varios ensayos clínicos muestran que los tratamientos de 3 a 6 meses de duración con 120-240 mg de Ginkgo biloba producen efectos significativos en pacientes con EA.
La propiedad de los flavonoides como captadores de radicales libres, unida a la actividad inhibidora del factor activador plaquetario que presentan algunos diterpenos (ginkgólido B), explican las propiedades vasorreguladoras de las hojas de Ginkgo biloba. El extracto flavónico de la hoja de esta planta actúa como vasoconstrictor venoso, vasodilatador arterial, reforzador de la resistencia capilar, inhibidor de la ciclooxigenasa y de la lipooxigenasa e inhibidor de la agregación plaquetaria y eritrocitaria. En el caso de las fracciones terpénicas, los ginkgólidos tienen propiedades antioxidantes, neuroprotectoras y colinérgicas que son relevantes en los mecanismos de la EA, y en numerosos experimentos realizados se ha observado un aumento en la expectativa de vida de las ratas y un efecto protector en las neuronas y los astrocitos frente a los daños de la isquemia transitoria. Ensayos clínicos controlados frente a placebo han demostrado que la eficacia terapéutica de los extractos de ginkgo en la EA es similar a la de fármacos como tacrina o donepezilo, y los efectos adversos del ginkgo son mínimos. Se recomienda el uso de las hojas de ginkgo en geriatría, especialmente en casos de trastornos de la circulación cerebral que afecten al área cognitiva.
El ginkgo puede utilizarse en forma de infusión (50 g de hojas en 500 mL de agua, tres veces al día), aunque en algunas farmacopeas no está permitida la infusión debido a la presencia de valores altos de ácidos ginkgólidos. También se utiliza en forma de extracto fluido (1:1) (0,5 mL, tres veces al día), o en forma de extractos secos estandarizados: cápsulas o comprimidos (de 120 a 240 mg/día, en 2-3 tomas); los mejores extractos estandarizados hacen referencia a una estandarización a partir de los flavonoides y lactonas terpénicas con un 24 y un 6%, respectivamente.
Los tratamientos son largos (6-12 semanas), con periodos de descanso de 4 semanas, y no se asocian a efectos adversos serios; pueden aparecer molestias gastrointestinales y cefaleas, aunque lo más común son las reacciones alérgicas, puesto que el ácido ginkgólido y la bilobina son estructuras alergénicas. No debe administrarse con sustancias anticoagulantes (ácido acetilsalicílico, heparina, acenocumarol, etc.) debido al riesgo de hemorragias, ni con inhibidores de la monoaminooxidasa.
 Ginseng («Panax ginseng» C.A. Meyer)
Ginseng («Panax ginseng» C.A. Meyer)
El ginseng es un arbusto de origen asiático, de 30 a 80 cm de altura; las hojas son tri- o pentapalmeadas, y las flores tienen una corola de color amarillo verdoso. El principio activo está en las raíces. Es una de las plantas medicinales más utilizadas a escala mundial. Posee efectos beneficiosos sobre ciertas funciones psicomotoras que podrían estar relacionados con sus acciones sobre los sistemas colinérgico y serotoninérgico y con las propiedades antioxidantes de la raíz, que evitan la sobreproducción de ácido nítrico. Ensayos clínicos en pacientes con EA han demostrado que es clínicamente eficaz, con mejoras significativas en el Mini-Mental Status Examination (MMSE), y en la escala para la Evaluación de la Enfermedad de Alzheimer (ADAS). Además, estudios recientes muestran que la eficacia del ginseng sobre la actividad cognitiva en pacientes con EA puede mantenerse hasta 2 años. La actividad se atribuye a los ginsenósidos Rb1 y Rg1, que poseen acción neurotrópica y neuroprotectora, aumentan la actividad de la enzima colin-acetiltransferasa y disminuyen la actividad de la enzima acetilcolinesteresa, incrementando por tanto la actividad colinérgica.
La dosis diaria es de 0,5-2 g de raíz o preparados equivalentes. La Comisión Europea y la OMS no establecen contraindicaciones para el ginseng. Sin embargo, el British Herbal Compendium lo contraindica en pacientes con hipertensión arterial, en aquellos con enfermedades graves o junto con bebidas estimulantes, particularmente bebidas con cafeína. Asimismo, también deben tener precaución las personas con arritmias cardiacas, ansiedad y palpitaciones.
«Melissa officinalis» (melisa)
Mejora la función cognitiva y reduce la agitación en pacientes con EA de leve a moderada. Varios estudios han demostrado que posee actividad sobre los receptores de la acetilcolina (nicotínicos y muscarínicos) en el sistema nervioso central, y que modula el comportamiento y la capacidad cognitiva. Los resultados muestran que los pacientes que recibían extracto de melisa tuvieron mejoras significativas en sus capacidades cognitivas y disminución de la agitación tras 16 semanas de tratamiento, y no existieron diferencias significativas en cuanto a la incidencia de efectos adversos comparado con placebo.
«Salvia officinalis» (salvia)
El extracto de salvia también produce beneficios significativos en las propiedades cognitivas en pacientes con demencia de leve a moderada tras 16 semanas de tratamiento. Los efectos adversos de la salvia son similares a los observados con los fármacos inhibidores de la acetilcolinesterasa.
Bibliografía
Avellana JA, Vilaplana AM. Enfermedad de Alzheimer. En: López A, Moreno L, Villagrasa V. Manual de farmacología. Guía para el uso racional del medicamento,
2.ª ed. Barcelona: Elsevier, 2010.
Castillo E, Solís-Martínez I, eds. Manual de fitoterapia. Barcelona: Elsevier, 2007.
Dodel R, Neff F, Noerkel C, Pul R, Du Y, Bacher M, et al. Intravenous inmunoglobulins as a treatment for Alzehimer's disease. Drugs. 2010; 70(5): 513-528.
Jordán J, Abizanda P, Galindo MF, Flórez J. Farmacología de las demencias y las conductas anormales. En: Flórez J. Farmacología humana, 6.ª ed. Barcelona: Elsevier-Masson, 2013.
Lee MS, Yang EJ, Kim J, Ernst E.J. Ginseng for cognitive function in Alzheimer's disease:
a systematic review. Alzheimers Dis. 2009; 18(2): 339-344.
Lin L, Huang Q, Yang S, Chu J, Wang J, Tian Q. Melatonin in Alzheimer's disease. Int J Mol Sci. 2013; 14(7): 14.575-14.593.
Lizasoain I, Moro MA, Leza JC. Farmacología de los procesos neurodegenerativos. Fármacos estimulantes del sistema nervioso central. En: Velázquez B. Farmacología, 18.ª ed. Madrid: Editorial Médica Panamericana, 2009.
Morales M, Bustamante S, Gallardo R. Aplicaciones clínicas del extracto de hoja de Ginkgo biloba. Revista de Fitoterapia. 2000; 1(2): 95-105.
Narendra S, Pandey BR, Verma P. An overview of phytotherapeutic approach in prevention and treatment of Alzheimer's syndrome & dementia. IJPSDR. 2011; 3(3): 162-172.
Perry EK, Pickering AT, Wang WW, Houghton PJ, Perry NS. Medicinal plants and Alzheimer's disease: from ethnobotany to phytotherapy. J Pharm Pharmacol. 1999; 51(5): 527-534.
Vanaclocha B, Cañigueral S, eds. Fitoterapia, vademécum de prescripción, 4.ª ed. Barcelona: Masson, 2003.
| Caso clínico |
| Una mujer acude a la farmacia porque su marido, diagnosticado recientemente de enfermedad de Alzheimer, presenta desde hace unos días dificultad para conciliar el sueño. Nos solicita un medicamento que ha visto anunciado en televisión para tratar el insomnio, que contiene doxilamina en su composición. Solución |

