Pese a que exista esta posibilidad, hay que tener en cuenta una serie de riesgos potenciales que podrían empeorar la salud del paciente (contando con factores como la automedicación), y por ello el papel del farmacéutico es esencial para el uso y aprovechamiento de estos medicamentos, garantizando así los criterios de eficacia y seguridad.
A lo largo de la historia, encontramos grandes ejemplos de medicamentos que inicialmente requerían receta y que de repente cambiaron su prescripción y hoy en día se distribuyen de forma libre en las farmacias y bajo el criterio del propio paciente y el consejo farmacéutico. Éste es el caso del conocido ibuprofeno para dolores agudos o el del paracetamol para episodios de fiebre. También encontramos antihistamínicos para el tratamiento de alergias (como la cetirizina o loratadina), inhibidores de la bomba de protones (omeprazol), antivirales para el tratamiento del herpes labial (penciclovir o aciclovir)2 o, ya más recientemente, el tratamiento anticonceptivo hormonal con levonorgestrel, conocido como «la píldora del día después», con su venta sin prescripción en España desde el año 20093.
Este tipo de cambio en la legislación es conocido como «switch», y se lleva a cabo no sólo en España y Europa, sino también a escala mundial. Esta propuesta tuvo su origen en Estados Unidos, donde los medicamentos Rx (de prescripción médica) y los OTC se comenzaron a diferenciar por primera vez en 1951 con la Enmienda Durham-Humphrey. Ésta definió los criterios conforme a los cuales los medicamentos de prescripción podrían ser usados sólo bajo la supervisión de un médico, mientras que todos los demás medicamentos podrían ser vendidos como «over the counter», fuera del mostrador. En 1962, las Enmiendas para Medicamentos Kefauver-Harris introdujeron controles más severos. En ese momento, los fabricantes tenían que probar no sólo la seguridad de los productos, sino también su eficacia en las indicaciones que se tenían previstas para ellos4.
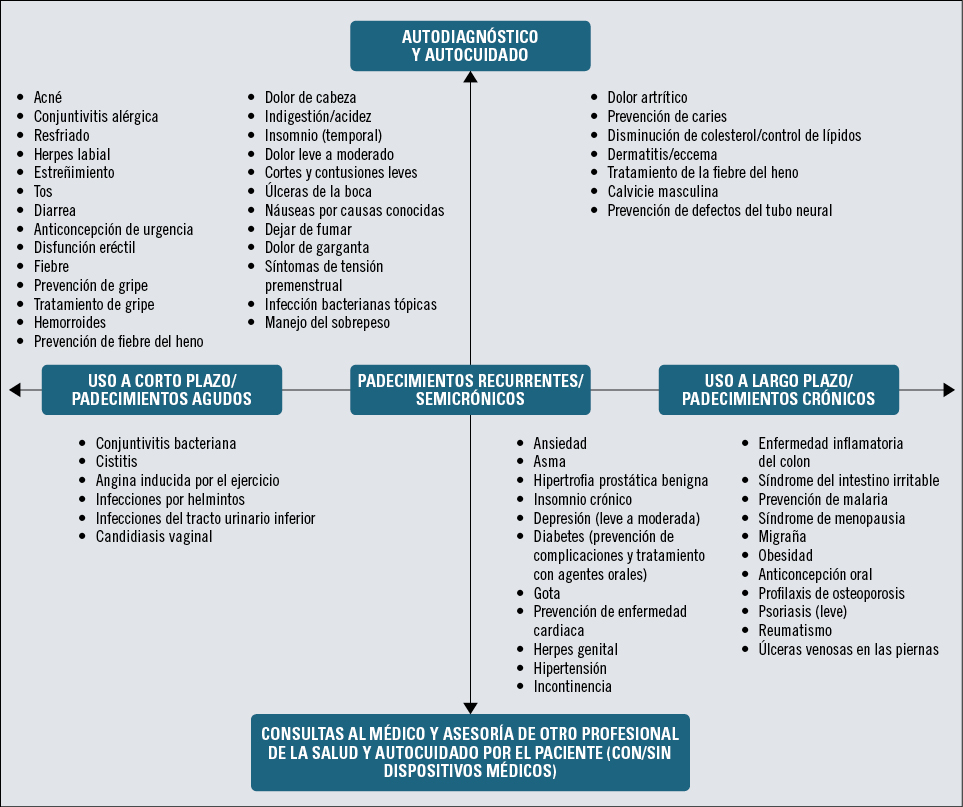
Actualmente, la World-Self Medical Industry nos indica para qué padecimientos inicialmente podrían ser considerados medicamentos sin prescripción médica, por su capacidad de autodiagnóstico y autocuidado (figura 1).
Criterios regulatorios
Aun así, ¿cuáles son los criterios regulatorios que un medicamento debe cumplir para considerar su switch?
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) postula que un medicamento no sujeto a prescripción médica debe considerar «procesos o condiciones que no necesiten un diagnóstico preciso y cuyos datos de evaluación toxicológica, clínica o de su utilización y vía de administración no exijan una prescripción médica»5.
Además, debe tenerse en cuenta que dicho medicamento:
• No se puede financiar con fondos públicos.
• No puede contener sustancias psicotrópicas ni estupefacientes.
• Tanto por su composición como por su objetivo debe estar destinado para su utilización sin la intervención de un médico que realice el diagnóstico, la prescripción o el seguimiento del tratamiento5.
Como es lógico, esta opción no es aplicable a cada medicamento que requiere de una prescripción médica, pues deben tenerse en cuenta todos los factores de seguridad y eficacia de su posible uso sin un control médico, ya que existen fármacos que pueden generar una dependencia o cuyos niveles de toxicidad y efectos adversos pueden ser elevados, incluso con la administración de otros medicamentos por las distintas interacciones que podrían conllevar.
A su vez, también en el momento de evaluar su disponibilidad debemos tener en cuenta la vía de administración y las consecuencias que pueden derivarse de su uso excesivo (dosis diaria máxima). Se valora también el tiempo de comercialización del producto registrado a lo largo de los años, así como el número de casos comunicados por farmacovigilancia, tanto de interacciones como de efectos adversos, teniendo en cuenta que, cuanto mayor sea el número de casos comunicados, menor será la aceptación como futuro candidato para un switch.
En cuanto a la documentación relativa a la toxicidad, el informe elaborado por los expertos (tanto por la parte clínica como por la no clínica) es fundamental para defender la propuesta de este switch. Ello conlleva que, si hubiera una aceptación futura, el cambio tanto del prospecto como de la ficha técnica debe tener en cuenta que la interpretación no sólo será llevada a cabo por un profesional de la salud, sino también por un grupo poblacional amplio6. Es esencial llevar un estudio poblacional sobre la comprensión del medicamento y, a su vez, sobre sus efectos secundarios, máxima dosis diaria y posibles interacciones con otros productos.
Beneficios
Y, una vez conseguido el switch, ¿qué beneficios para el paciente y el sistema público de salud podemos esperar?
Está claro que existen muchos puntos a favor que apoyan este switch, más allá de la comodidad que se le ofrece al paciente al poder obtener un medicamento sin la necesidad de invertir su tiempo en visitas al médico para cada prescripción. Hay un estudio que analiza cómo se lleva a cabo la venta y distribución de medicamentos con prescripción en 157 farmacias del país, distribuidas por diferentes comunidades y localidades, y entre otros datos muestra que, de una demanda total de 61.114 medicamentos, 5.345 (8,7%) se solicitaron con receta médica, aunque no era un requisito necesario para su dispensación. Asimismo, la demanda de medicamentos que precisaban obligatoriamente receta fue de 55.769 (100%). Se presentó la receta para 49.564 (88,9%) medicamentos y se demandaron 6.205 (11,1%) sin la correspondiente receta médica. ¿Qué sucede con aquellos medicamentos que se dispensaron sin la correspondiente receta médica y cuáles fueron los motivos para su dispensación? Es evidente que la prescripción sin receta sucede con bastante frecuencia, sobre todo en el ámbito de la odontología y la pediatría7. Esto puede ser debido, por ejemplo, a la continuación de un tratamiento ya prescrito, a una prescripción oral por teléfono del médico, a la automedicación, o motu proprio por parte del farmacéutico ante una consulta de consejo farmacéutico8.
No cabe duda de que, en muchas ocasiones, esta práctica se debe regular, pero en otras la posibilidad de un switch puede beneficiar también al sistema de salud, disminuyendo las listas de espera en ambulatorios y hospitales para trastornos comunes y molestos cuyos síntomas son fácilmente reconocibles (como fiebre y herpes labial), y reduciendo el tiempo desde la aparición de los síntomas hasta su tratamiento4.
Esto también supone un ahorro estatal en la subvención de algunos medicamentos y, además, la población cada vez está más concienciada sobre el uso racional del medicamento debido al libre acceso a la información, así como a la valoración del consejo farmacéutico en cada ocasión. El papel de la oficina de farmacia es esencial para contribuir a la mejora de la salud pública, así como al bienestar del paciente.
Bibliografía
1. BOE. Ley 25/1990, de 20 de diciembre, del Medicamento (Artículo 31). Madrid: s.n., 1990.
2. CIMA. AEMPS. Última consulta: 15 de julio de 2017. Disponible en: https://www.aemps.gob.es/cima/inicial.do.
3. QUE! que.es. 20 de febrero de 2015. Última consulta: 15 de julio de 2017. Disponible en: http://www.que.es/estilo-de-vida/201502200800-pildora-despues-precio-efectos-secundarios.html.
4. WSMI. RECLASIFICACIÓN. Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta, 2009.
5. Farmacología. División de Evaluación Clínica y Condiciones para autorizar medicamentos no sujetos a prescripción médica y/o publicitarios. Madrid: AEMPS/Ministerio de Sanidad y Consumo, 2008.
6. EMA. A Guideline on changing the classification for the supply of a medicinal product for human use. European Comission. Bruselas: January 2006.
7. Barbero-González A, Pastor-Sánchez R, Arco-Ortiz de Zárate J, Eyaralar-Riera T, Espejo-Guerrero J. Demanda de medicamentos de prescripción sin receta. Aten Primaria. 2006; 37(2): 78-87.
8. Caamaño F, Figueiras A, Lado Lema E, Gestal-Otero JJ. La automedicación: concepto y perfil de sus «usuarios». Gac Sanit. 2000; 14: 264-269.