En la actualidad, se da mucha importancia a las modulaciones de la microbiota intestinal mediante los alimentos funcionales constituidos por probióticos, prebióticos y simbióticos. En este artículo, se hace una breve revisión sobre la función de estos alimentos funcionales y el efecto beneficioso que pueden ejercer sobre la salud del individuo.
Su uso, aunque se ha extendido de forma considerable, no está del todo incorporado a la práctica clínica habitual debido a los resultados poco concluyentes de los estudios clínicos. Cada vez se dispone de más evidencia sobre las acciones beneficiosas de su administración, pero para ello es necesario que la cepa de probiótico específica, el prebiótico o simbiótico cumplan condiciones terapéuticas que estén respaldadas por ensayos clínicos de suficiente poder estadístico1.
El término «microbiota» (microflora, flora) engloba la comunidad de microorganismos vivos pertenecientes a un nicho ecológico determinado.
La «microbiota de la piel» incluye alrededor de un 95% de bacterias, y el resto son hongos lipofílicos y ácaros que viven en los folículos pilosos. La colonización de la piel no es uniforme y, así, en las zonas más secas (antebrazos, dorso de manos, etc.) hay pocos microorganismos. Los pliegues (axilas, ingles, etc.) y regiones sebáceas (cuero cabelludo, espalda, etc.) son zonas más húmedas y allí predominan diferentes tipos de bacterias2.
La «microbiota del aparato genitourinario» varía mucho de hombres a mujeres. En los hombres es escasa debido a que la orina lava la uretra regularmente y a que el orificio de salida está muy separado del ano. En las mujeres, la microbiota vaginal varía con la actividad endocrina y aumenta de manera significativa durante el periodo fértil, especialmente en el embarazo2.
La «microbiota intestinal» incluye más de 100 billones de bacterias de más de 1.000 especies diferentes. La presencia de la microflora es creciente en cantidad y variedad, empezando en el estómago, donde es escasa, pasando por el intestino delgado, donde aumenta, y finalizando por el colon, donde es máxima.
La flora intestinal se adquiere desde el nacimiento y se desarrolla en función del régimen alimentario del niño hasta los 2 o 3 años, edad en la que se considera que la microbiota está madura y compensada. La lactancia materna constituye el factor más importante en el desarrollo de la microbiota intestinal del niño, ya que la leche materna aporta bacterias de manera continua3.
La microbiota también puede originar daños, especialmente infecciones endógenas de carácter oportunista y generación de compuestos carcinogénicos2.
Existen numerosos factores que pueden alterar la composición de nuestra flora intestinal (disbiosis): trastornos gastrointestinales (diarreas, infecciones, etc.), edad, estrés, estados de inmunosupresión, vacunas, dieta inadecuada y uso de fármacos, siendo los antibióticos el ejemplo más claro de medicamentos que alteran su equilibrio.
 Probióticos
Probióticos
El término «probióticos» fue introducido por primera vez en 1965 por Lilly y Stillwell. En 1989, Roy Fuller subrayó el hecho de que, para que un microorganismo se considerara probiótico, debía estar presente en estado viable, e implantó la idea de que debía ejercer un efecto beneficioso sobre el huésped4.
La Organización Mundial de la Salud (OMS) define los probióticos como «microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio a la salud del consumidor»2.
A la hora de optar por un probiótico (tabla 1), es primordial que la cepa elegida (que se cataloga en función de su género, especie y de una designación alfanumérica) sea específica para la acción concreta de salud (no vale cualquier probiótico) y que haya estudios controlados que avalen su eficacia y su inocuidad. Una cepa microbiana que demuestra ser eficaz en una indicación concreta no es necesariamente válida para otras indicaciones, y las evidencias científicas observadas en un tipo de población no son extrapolables a otra que varíe en edad o en estado fisiológico5.
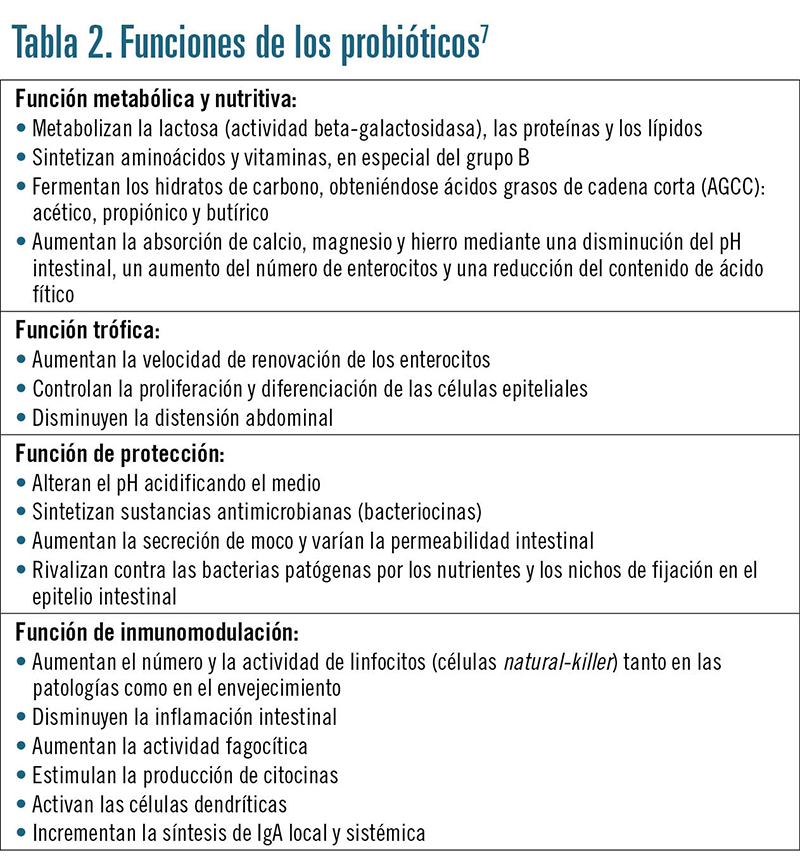 Además, el producto debe aportar la dosis adecuada de microorganismos viables, y es fundamental su estabilidad. Algunos autores afirman que es imprescindible una cantidad de 107-108 ufc (unidades formadoras de colonias) para que el probiótico mantenga su función, ya que si baja a 106 es incapaz de ser beneficioso para la salud. También es necesario ingerirlo diariamente, pues hay estudios que demuestran que, si se toma de forma alterna (2-3 días a la semana), su acción es menor o casi imperceptible6,7. En la tabla 2 se esquematizan las funciones que caracterizan a los probióticos.
Además, el producto debe aportar la dosis adecuada de microorganismos viables, y es fundamental su estabilidad. Algunos autores afirman que es imprescindible una cantidad de 107-108 ufc (unidades formadoras de colonias) para que el probiótico mantenga su función, ya que si baja a 106 es incapaz de ser beneficioso para la salud. También es necesario ingerirlo diariamente, pues hay estudios que demuestran que, si se toma de forma alterna (2-3 días a la semana), su acción es menor o casi imperceptible6,7. En la tabla 2 se esquematizan las funciones que caracterizan a los probióticos.
Los probióticos presentan un buen perfil de seguridad, por lo que los efectos adversos no suelen ser habituales.
Están contraindicados en pacientes:
- Inmunodeprimidos o en tratamiento con inmunosupresores.
- Con enfermedades autoinmunes.
- Con diarreas sanguinolentas.
- Convalecientes de cirugía cardiaca.
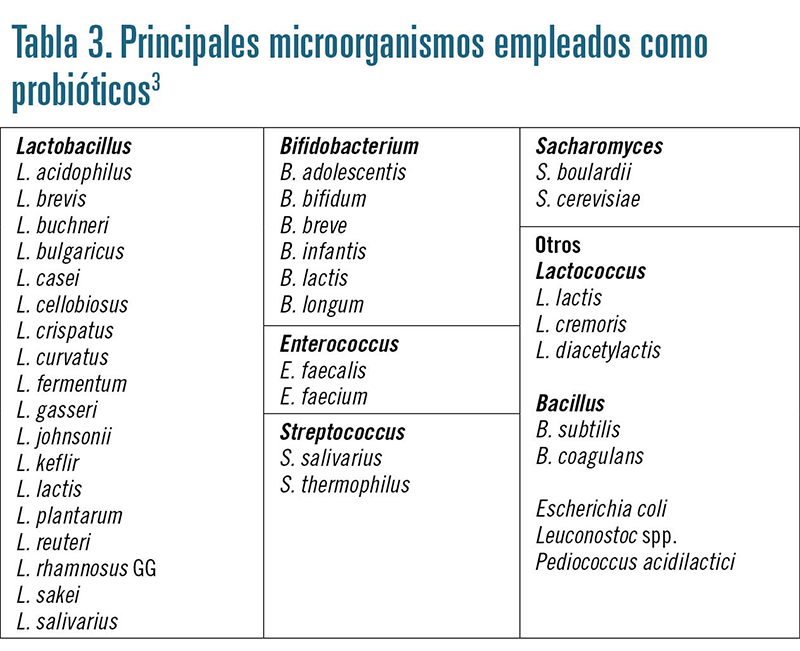 En principio, cualquier microorganismo de la microbiota puede ser un probiótico (tabla 3), pero en la práctica la mayoría pertenecen a dos grupos: lactobacilos y bifidobacterias. Probablemente esto se debe a que son los únicos que son inocuos en casi cualquier circunstancia y han sido reconocidos como organismos GRAS (Generally Recognized As Safe) y QPS (Qualified Presumption of Safety) por la Food and Drug Administration (FDA) y la European Food Safety Authority (EFSA), respectivamente2.
En principio, cualquier microorganismo de la microbiota puede ser un probiótico (tabla 3), pero en la práctica la mayoría pertenecen a dos grupos: lactobacilos y bifidobacterias. Probablemente esto se debe a que son los únicos que son inocuos en casi cualquier circunstancia y han sido reconocidos como organismos GRAS (Generally Recognized As Safe) y QPS (Qualified Presumption of Safety) por la Food and Drug Administration (FDA) y la European Food Safety Authority (EFSA), respectivamente2.
En cuanto a los productos comerciales, es muy importante mantener la viabilidad. Ésta depende del formato en el que se vayan a administrar las bacterias, ya que, por ejemplo, la vida útil de los productos lácteos probióticos refrigerados es marcadamente más corta que la de los liofilizados que se presentan en cápsulas o polvos. En cualquier caso, siempre hay una cierta proporción de bacterias que mueren o resultan dañadas durante el proceso productivo o el almacenamiento del preparado. En la industria, los métodos más empleados para garantizar esta viabilidad son la sobredosificación del producto, para asegurar un nivel óptimo de bacterias al final de la vida del artículo, la encapsulación y la inducción de procesos celulares que aumentan la tolerancia a los efectos externos ambientales8.
La etiqueta de un producto que contenga probióticos debe incluir:
- Género, especie y cepa de los microorganismos.
- Dosis mínima de bacterias viables al final de la vida útil.
- Dosis de producto que debe consumirse para que sea efectiva.
- Descripción del efecto o efectos beneficiosos.
- Condiciones de almacenaje.
- Datos de la seguridad del producto.
- Datos de contacto con el servicio de atención al cliente.
Prebióticos
Una de las definiciones más claras es la de la World Gastroenterology Organisation (WGO): «sustancias de la dieta (fundamentalmente polisacáridos no amiláceos y oligosacáridos no digeribles por enzimas humanas) que nutren a grupos seleccionados de microorganismos que habitan en el intestino, favoreciendo así el crecimiento de bacterias beneficiosas sobre las nocivas»9.
Los requisitos que debe tener un prebiótico son:
- Ser de origen vegetal.
- No ser hidrolizado en el tracto gastrointestinal superior (ser resistente a la acidez gástrica y a las enzimas digestivas).
- No absorberse en el intestino delgado.
- Ser fermentado selectivamente por bacterias beneficiosas de la microbiota en el intestino grueso y facilitar el crecimiento de éstas.
- Poseer eficacia demostrada para inducir efectos beneficiosos para la salud.
- Ser osmóticamente activo, aumentando el peso de las heces y la frecuencia de la evacuación intestinal.
Estructuralmente son oligo- y polisacáridos de fructosa (FOS e inulina, respectivamente) y de galactosa (GOS). También se emplean compuestos mixtos, como la lactulosa y el lactitiol. Existen otros hidratos de carbono considerados como prebióticos, pero de los que no se dispone de evidencia científica, como son los xilooligosacáridos (XOS), la lactosacarosa (LS), los isomaltooligosacáridos (IMOS), los oligosacáridos de soja y los glucooligosacáridos. Otros, como los pectooligosacáridos (POS), la polidextrosa (PDX) y los polisacáridos de macroalgas, están en fases iniciales de estudio10.
Los prebióticos estimulan el crecimiento de bacterias fermentativas (bifidobacterias y lactobacilos) en el colon, consiguiendo efectos beneficiosos; generan ácidos grasos de cadena corta que producen un descenso de pH, de forma que consigue controlarse el desarrollo de microorganismos perjudiciales.
También favorecen la absorción de minerales (calcio, magnesio, hierro y zinc), reducen la presión arterial y los niveles de colesterol (inhiben la HMG-CoA reductasa), de triglicéridos y de fosfolípidos en sangre. Asimismo, los niveles de glucosa disminuyen, ya que la fibra soluble retrasa el vaciado gástrico y parece reducir la resistencia a la insulina.
Por otra parte, poseen efecto protector frente a infecciones intestinales. Se han descrito como mecanismos la liberación por parte de los microorganismos de agentes antimicrobianos de amplio espectro de acción y el bloqueo de los lugares en los que se adhieren los patógenos o sus toxinas en las células epiteliales del intestino9.
Su acción laxante se explica porque reducen el tiempo de tránsito intestinal, y aumentan el volumen del bolo fecal y el número de deposiciones. Por supuesto, es importante establecer la ingesta adecuada, ya que si es excesiva pueden provocar efectos secundarios molestos, como flatulencia, retortijones y diarrea.
Para establecer la ingesta adecuada de los prebióticos hay que considerar9,10:
- El tipo de oligosacárido, aunque la mayoría incrementa la población de bifidobacterias cuando se consumen 15 g/día.
- La microbiota intestinal de cada individuo, ya que el número de bifidobacterias presentes antes de empezar la suplementación es determinante. Así, por ejemplo, en personas de edad avanzada, cuyo número de bifidobacterias antes de empezar la suplementación suele ser bajo, la ingesta de 2,5 g/día puede ser suficiente para originar el aumento de ellas.
Simbióticos
Se denomina «simbiótico» a la mezcla de uno o más organismos probióticos con uno o varios compuestos prebióticos.
El objetivo es favorecer la actividad de ambos componentes para potenciar sus propiedades saludables gracias al efecto sinérgico que existe entre ellos.
Esto implica que sólo puede ser simbiótico el producto que demuestra ejercer un efecto beneficioso superior a la suma de los generados por sus integrantes por separado11.
Los simbióticos son la principal táctica para la integración del probiótico en el ecosistema, ya que aumentan la vida útil de éste y, además, dan un sustrato específico para la microbiota residente.
Aplicaciones clínicas
Las posibilidades terapéuticas de probióticos y prebióticos son numerosas, y diariamente se publican nuevas. Aun así, en todos los casos deben basarse en la evidencia científica probada y específica.
Sistema inmunitario
Los microrganismos estimulan el sistema inmunitario y actúan tanto sobre las células implicadas en la inmunidad natural como en la específica y también sobre los macrófagos. Además, favorecen la producción de anticuerpos, específicamente de IgA en la luz intestinal, que a su vez inhiben la adhesión de las bacterias patógenas.
Las bacterias lácticas pueden actuar como inmunomoduladoras protegiendo al individuo de las infecciones, promoviendo la producción de Ig y aumentando el número de linfocitos.
Varios estudios han demostrado que las bacterias, fundamentalmente del género Lactobacillus spp., activan la respuesta inmunológica.
Son necesarios más estudios para demostrar su efecto beneficioso en dermatitis atópica, donde el uso de L. rhamnosus GG en mujeres embarazadas ha demostrado ejercer una disminución significativa de su incidencia en el recién nacido12. El tratamiento con L. rhamnosus LR05, B. lactis BS01 y FOS reduce de forma significativa su gravedad después de 2 y 4 meses de tratamiento. Se ha registrado también una reducción en el uso de corticosteroides, antihistamínicos e inhibidores de calcineurina13.
Los resultados obtenidos en un estudio con dos simbióticos multi-cepas (L. acidophilus NCFM/B. lactis BL-04/ FOS y L. plantarum LP01/L. paracasei LPC00/FOS) durante un periodo de 4 meses apoyan el efecto positivo en la gestión clínica habitual de las rinitis alérgica estacional y perenne. Son necesarios estudios futuros para confirmar este potencial efecto beneficioso14.
Con respecto a la prevención de la alergia alimentaria, se sabe poco sobre la eficacia de los probióticos.
Los probióticos en la mujer
La microbiota vaginal y mamaria está formada por microorganismos que conviven en un delicado equilibrio. Su alteración da lugar a infecciones como vaginosis bacteriana, vaginitis candidiásica y mastitis (muy común durante la lactancia).
En el tratamiento de la mastitis, causada básicamente por Staphylococcus spp., las cepas que han demostrado mayor actividad son L. coryniformis CECT5711, L. fermentum CECT5716, L. gasseri CECE5714 y L. salivarius CECT5713. Se ha comprobado su efectividad para restaurar el equilibrio de la microbiota mamaria y eliminar los síntomas. Además, han mostrado una gran superioridad frente al tratamiento con antibióticos, ya que la mejoría de los síntomas es superior y las recurrencias y los efectos adversos son menos frecuentes11,15.
La aplicación de comprimidos vaginales con L. fermentum LF15 y L. plantarum LP01 reduce de manera concluyente las recurrencias de vaginosis bacteriana16.
Aunque la administración de probióticos (tanto por vía oral como vaginal) ha demostrado una gran eficacia, se observa mayor respuesta por vía oral. Deben usarse como coadyuvantes a los tratamientos con antibióticos o antifúngicos.
En la vulvovaginitis candidiásica no existe evidencia de que haya una disminución de Lactobacillus, pero la administración vaginal de L. plantarum I1001 ha resultado ventajosa en la prevención de recurrencias como coadyuvante del tratamiento antifúngico17.
La diabetes mellitus gestacional (DMG) se trata actualmente con dieta y, si es necesario, también con medicación. De momento sólo se dispone de un estudio controlado aleatorizado con 256 pacientes, en el que se ha hallado una tasa inferior de DMG en aquellas que tomaron probióticos desde el primer trimestre de embarazo, por lo que no pueden establecerse conclusiones definitivas18.
 Probióticos y lactantes
Probióticos y lactantes
La colonización bacteriana comienza en el momento del parto, cuando el feto entra en contacto con la microbiota intestinal y vaginal de la madre. Además, la leche materna aporta su propia microbiota y oligosacáridos que estimulan el crecimiento de las bacterias. Por todo ello, el perfil microbiano de los lactantes alimentados con leche materna sirve de referencia para desarrollar las fórmulas lácteas infantiles.
También se estudia la posible existencia de una circulación enteromamaria que se intensifica al final del embarazo y durante la lactancia, lo que da la posibilidad de modular la microbiota mamaria mediante la administración de probióticos a la madre.
Los resultados de los ensayos controlados y aleatorizados han demostrado un evidente beneficio de los probióticos en la prevención de las infecciones gastrointestinales agudas en lactantes y niños sanos. Entre las cepas de probióticos empleados están L. rhamnosus GG, S. thermophilus L. y B. lactis, mezclados con leche o fórmula infantil o administrados como un suplemento oral.
Por otra parte, en cuanto a los prebióticos, se ha destacado que, en concentraciones suficientes y con una relación FOS/GOS adecuada, facilitan la formación de un ecosistema intestinal similar al que genera la leche materna y protegen frente a algunas enfermedades.
El Comité de Nutrición de la Sociedad Europea de Gastroenterología Pediátrica, Hepatología y Nutrición (ESPGHAN) considera que se necesitan más estudios controlados y aleatorizados para ratificar la total seguridad y eficacia en el uso de probióticos y prebióticos en niños, aunque, hasta la fecha, estos productos se han mostrado inocuos. Por otra parte, la Organización de las Naciones Unidas para la Agricultura y la Alimentación apoya el suplemento con productos prebióticos de las fórmulas infantiles de continuación19.
Enterocolitis necrotizante
Se han realizado estudios controlados y aleatorizados que demuestran que el tratamiento profiláctico con probióticos reduce el riesgo de enterocolitis necrotizante los días de hospitalización y la mortalidad de los recién nacidos prematuros20-22.
Cólico del lactante
La cepa L. reuteri DSM 17938 puede mejorar los síntomas de cólicos estimulando la motilidad intestinal y calmando el dolor visceral al ejercer efectos directos en la vía nerviosa1. Mediante su administración, en forma liofilizada, en una dosis de 108 ufc/día, se observó una tasa de respuesta (disminución del tiempo de llanto) significativamente mayor en los lactantes tratados frente a los que recibieron placebo22,23. No se observaron efectos adversos del tratamiento en ninguno de los estudios.
En un estudio reciente también se ha observado la eficacia de la cepa L. rhamnosus GG en los lactantes prematuros que padecen cólicos1.
Patologías gastrointestinales
Es lógico que un gran número de indicaciones terapéuticas de los productos con probióticos se localicen en el aparato digestivo.
 Diarrea aguda
Diarrea aguda
Las revisiones sistemáticas confirman el efecto beneficioso de los probióticos, sobre todo en las gastroenteritis víricas, y son más considerables cuanto más tempranamente se administren.
Las principales cepas que han demostrado su eficacia son: L. rhamnosus GG, S. boulardii, S. cerevisiae y L. reuteri ATCC 55730. Se ha demostrado, en estudios realizados en su mayor parte en niños, que atenúan la gravedad de la diarrea disminuyendo el número de deposiciones y reduciendo la duración de ésta4,20.
Actualmente, los principales protocolos de tratamiento en diarrea aguda infecciosa contemplan el uso conjunto de probióticos y soluciones de rehidratación oral.
Diarrea por Clostridium difficile
Una revisión de 23 estudios (4.213 participantes) que evaluaron la efectividad de los probióticos para la prevención de la diarrea asociada al C. difficile (DACD) en pacientes que estaban siendo tratados con antibióticos demostró que su administración con antibióticos reduce el riesgo de desarrollar DACD en un 64%. Se constató que el uso de probióticos reduce la frecuencia de efectos adversos (dolor abdominal, náuseas, fiebre, heces blandas, flatulencias y trastorno del gusto) en una revisión de 26 estudios (3.964 participantes), evidenciando así su seguridad a corto plazo en pacientes que no están gravemente debilitados ni inmunocomprometidos24.
Los probióticos más eficaces fueron: S. boulardii y mezclas de lactobacilos: L. acidophilus CL1285 + L. casei LBC80R y L. acidophilus + B. bifidum20.
Diarrea asociada al uso de antibióticos
L. rhamnosus GG y S. boulardii han demostrado su eficacia en la prevención de la diarrea asociada a antibióticos en niños4. No se pueden hacer recomendaciones sobre la eficacia de ninguno de los otros probióticos o de las combinaciones de estos25. Sólo se han descrito efectos secundarios graves con S. boulardii en inmunodeprimidos o portadores de catéteres centrales25.
En adultos se han empleado, además de L. rhamnosus GG y S. boulardii, otras cepas como E. faecium LABSF68, L. casei DN-114001, Bacillus clausii y mezclas como L. acidophilus CL1285 + L. casei LBC80R, que también han demostrado su eficacia.
No se dispone de estudios concluyentes para recomendar de forma rutinaria el uso de antibióticos y probióticos, por lo que debe individualizarse en función del paciente y tipo de antibiótico. La administración del probiótico debe realizarse al iniciar el tratamiento y no cuando ha comenzado la diarrea, ya que entonces no ofrece beneficios20.
Diarrea del viajero
Los prebióticos podrían ejercer un efecto protector, ya que, según un estudio, su ingesta 2 semanas antes del viaje disminuye la duración de la diarrea, así como la gravedad de la sintomatología9.
Estreñimiento
En un estudio en lactantes, el empleo de prebióticos (FOS) se mostró efectivo para aumentar el número de deposiciones y reducir su consistencia, debido al aumento de la capacidad de retención de agua en las heces y al estímulo del crecimiento de bifidobacterias como resultado de su fermentación en el colon. Es importante tener en cuenta que los efectos son dosis-dependientes22.
Existen estudios del uso de diferentes cepas de Lactobacillus que actuarían aumentando el peristaltismo intestinal de los lactantes. Sin embargo, no se dispone de evidencia suficiente para su recomendación habitual27.
En adultos suelen usarse los prebióticos para tratar el estreñimiento, pero también los probióticos. Los que se utilizan con mayor frecuencia son determinadas cepas de Lactobacillus y Bifidobacterium, que actúan reduciendo la consistencia de las heces. No obstante, la eficacia de su administración en pacientes que ya padecen estreñimiento es controvertida.
Erradicación de Helicobacter pylori
El uso de L. rhamnosus GG, L. acidophilus, L. casei DN 114001, S. boulardii, L. reuteri ATCC 55730, L. gasseri y B. infantis 2036 junto con el tratamiento antibiótico ha demostrado que las tasas de erradicación son superiores. Además, parecen reducir los efectos colaterales de las terapias antibióticas y mejorar la adherencia de los pacientes4,20.
Aun así, el resultado de las revisiones no es concluyente.
Enfermedad inflamatoria intestinal (EII)
Las cepas de E. coli Nissle 1917 y L. rhamnosus GG son tan efectivas como la mesalazina en el mantenimiento de la remisión de la colitis ulcerosa1,27. La mezcla VSL#3 (L. casei, L. plantarum, L. acidophilus, L. delbrueckii ssp. bulgaricus, B. longum, B. breve, B. infantis y Streptococcus salivarius ssp. thermophilus) ha demostrado ser eficaz, induciendo y manteniendo la remisión en niños y adultos con procesos de colitis leves a moderadas20,27.
En cuanto al uso de prebióticos, la administración de inulina (sola o con probióticos) asociada a mesalazina disminuye los marcadores inflamatorios27.
Existe una clara evidencia que muestra la utilidad de la mezcla VSL#3 tanto para impedir una crisis inicial de pouchitis como para evitar recidivas futuras, aunque se desconoce si su uso tiene un efecto superior al de una única cepa de probiótico4,27.
También el empleo de la inulina ha demostrado su efectividad.
En la enfermedad de Crohn se han estudiado diferentes probióticos, pero ninguno ha demostrado ser beneficioso cuando se usa sólo ni empleado en combinación con el tratamiento convencional4,20,27.
Síndrome del intestino irritable (SII)
Las combinaciones de lactobacilos y bifidobacterias y el L. plantarum DSM9843 fueron las que mostraron mayor efectividad. En pacientes pediátricos obtuvo buenos resultados la mezcla VSL#3 tras 5-6 meses de tratamiento. Otras cepas que también han demostrado algún efecto beneficioso en el tratamiento del SII fueron el E. coli DSM 17252 y el L. rhamnosus GG20.
 Obesidad
Obesidad
Determinadas cepas de probióticos podrían regular el peso corporal al influir en las funciones neuroendocrinas, inmunitarias y metabólicas. Parece ser que las personas obesas presentan alteraciones en la composición de la microbiota intestinal, en comparación con sus homólogos delgados28.
Hasta la fecha, los estudios clínicos con humanos no presentan suficiente evidencia científica para recomendar la utilización de probióticos en el tratamiento de la obesidad.
En cuanto a los prebióticos, también es importante el incremento de la sensación de saciedad que producen las fibras.
Otras patologías
Infecciones urinarias
Las pruebas actualmente disponibles no muestran una reducción de estas infecciones con la administración de probióticos29.
Malabsorción de lactosa
Varios estudios controlados y aleatorizados han confirmado que las cepas S. thermophilus y L. delbrueckii ssp. bulgaricus optimizan la digestión de la lactosa y disminuyen los síntomas de la intolerancia a ella4.
Neumonía asociada al respirador (NAR)
Los resultados de varios estudios indican que el uso de los probióticos se asocia a una reducción de los casos de NAR. Sin embargo, la calidad de las pruebas es baja y existen numerosas contradicciones, por lo que son necesarios estudios más amplios30.
Cáncer
Los resultados del estudio SYNCAN (proyecto patrocinado por la Unión Europea) sobre el efecto de la simbiosis de FOS más dos cepas de probióticos (lactobacilos y bifidobacterias) en pacientes con riesgo de desarrollar cáncer de colon, apuntan que puede disminuir la expresión de biomarcadores4.
Encefalopatía hepática
Los prebióticos como la lactulosa se emplean habitualmente para la prevención y el tratamiento de esta complicación de la cirrosis.
Se ha logrado revertir una encefalopatía hepática mínima en el 50% de los pacientes tratados con una preparación simbiótica (cuatro cepas de probióticos y cuatro fibras fermentables que incluían inulina y almidón resistente) durante 30 días4.
Prevención de infecciones sistémicas y posquirúrgicas
Existen estudios controlados que reconocen para algunos simbióticos una prevención efectiva de infección bacteriana posquirúrgica. También debe estar controlado el tiempo de tratamiento y no sobrepasar los límites de inocuidad. Se ha comprobado que pacientes con alto riesgo de infecciones, como los sometidos a intervenciones hepatopancreáticas, politraumáticas, etc., se benefician mejor del tratamiento simbiótico que otros pacientes sometidos a otras prácticas quirúrgicas. Como en otros casos, para su aplicación definitiva son necesarios más trabajos de investigación31.
Bibliografía
1. Álvarez G, Azpiroz F. Empleo de probióticos y prebióticos en atención primaria. Nutr Hosp. 2015; 31(Supl 1): 59-63.
2. Suárez JE. Microbiota autóctona, probióticos y prebióticos. Nutr Hosp. 2015; 31(Supl 1): 3-9.
3. Hernández A, Coronel C, Monge M, Quintana C. Microbiota, probióticos, prebióticos y simbióticos. Pediatría Integral. 2015; XIX(5): 337-354.
4. Guarner F, Khan GA, Garisch J, Eliakim R, Gangl A, Thomson A, et al. Guía Práctica de la Organización Mundial de Gastroenterología: Probióticos y Prebióticos, 2011. Disponible en: http://www.worldgastroenterology.org/guidelines/global-guidelines/probiotics-and-prebiotics/probiotics-and-prebiotics-spanish
5. Álvarez G, Arroyo R, Aznar R, Azpiroz F, Bartolomé B, Bixquert M, et al. Probióticos y salud. Evidencia científica. SEPyP (Sociedad Española de Probióticos y Prebióticos), 2009. Disponible en: http://www.sepyp.es/pdf/Documento-de-Consenso-sobre-Probioticos.pdf
6. Gómez S, Nova E, Marcos A. Probióticos. Guarner F. Alimentos prebióticos. En: Aguilera C, Barberá JM, Díaz LE, Duarte A, Gálvez J, Gil A, et al. Alimentos funcionales. Aproximación a una nueva alimentación. Madrid: Dirección General de Salud Pública y Alimentación. Disponible en: http://www.madrid.org/cs/Satellite?blobcol=urldata&blobheader=application%2Fpdf&blobheadername1=Content-Disposition&blobheadervalue1=filename%3Dt065&blobkey=id&blobtable=MungoBlobs&blobwhere=1220428576848&ssbinary=true
7. Pardo C. Los probióticos y prebióticos en la farmacia comunitaria. SEFAC. Taller «Actualización en indicación y uso de probióticos», 2013. Disponible en: http://www.sefac.org/buscar/probioticos
8. Rodríguez JM. Probióticos: del laboratorio al consumidor. Nutr Hosp. 2015; 31(Supl 1): 33-47.
9. Corzo N, Alonso L, Azpiroz F, Calvo MA, Cirici M, Leis R, et al. Prebióticos: concepto, propiedades y efectos beneficiosos. Nutr Hosp. 2015; 31(Supl 1): 99-118.
10. Corzo N, Alonso JL, Azpiroz F, Calvo MA, Cirici M, Leis R, et al. Consenso científico sobre prebióticos. SEPyP (Sociedad Española de Probióticos y Prebióticos), 2014. Disponible en: http://www.sepyp.es/pdf/docConsensoPrebioticos.pdf
11. Beltrán DA, Crespo AE, Rodríguez TC, García A. Mastitis infecciosa: nueva solución para un viejo problema. Nutr Hosp. 2015; 31(Supl 1): 89-95.
12. Zafrilla P, Cerdá B. Probióticos. Revisión Farmacéuticos comunitarios. 2009; 1(3): 116-123.
13. Manzotti G, Heffler E, Fassio F. Probióticos como nuevos adyuvantes en el tratamiento de la dermatitis atópica. Nutr Hosp. 2015; 31(Supl 1): 145.
14. Manzotti G, Heffler E, Fassio F. Simbióticos multicepas como nuevos adyuvantes en el tratamiento de la rinitis alérgica. Nutr Hosp. 2015; 31(Supl 1): 145.
15. Álvarez G, Suárez E, Rodríguez JM, Pérez-Moreno J. La microbiota en la mujer; aplicaciones clínicas de los probióticos. Nutr Hosp. 2015; 32(Supl 1): 56-61.
16. Palacios S, Vicariotto F, Mogna L, Mogna G, Del Piano M, Losa F, et al. Efectividad de dos microorganismos, L. fermentum LF15 y L. Plantarum LP01, formulados en comprimidos vaginales de liberación lenta, en mujeres con vaginosis bacteriana: un estudio piloto. VII Workshop 2016. Probióticos, Prebióticos y Salud. Evidencia Científica. SEPyP (Sociedad Española de Probióticos y Prebióticos), 72. Disponible en: http://www.sepyp.es/es/workshop2016/recopilatorio
17. Palacios S, Salas N, Fernández-Moya JM, Bajona M, Prieto C, Espadaler, J. Lactobacillus plantarum I1001 en la prevención de la candidiasis vulvovaginal recurrente. VII Workshop 2016. Probióticos, Prebióticos y Salud. Evidencia Científica. SEPyP (Sociedad Española de Probióticos y Prebióticos). Disponible en: http://www.sepyp.es/es/workshop2016/recopilatorio
18. Barrett H, Dekker Nitert M, Conwell L, Callaway L. Probióticos para la prevención de la diabetes gestacional. Cochrane Database Syst Rev. 2014; 2: CD009951. DOI: 10.1002/14651858.CD009951
19. Martínez V. Uso de probióticos y prebióticos en las fórmulas infantiles. Nutr Hosp. 2015; 31(Supl 1): 72-77.
20. Díaz JJ, González D. Aplicaciones en gastroenterología. Nutr Hosp. 2015; 31(Supl 1): 21-25.
21. Suárez M, Solís G. Empleo de probióticos en la prevención de la enterocolitis necrotizante en recién nacidos prematuros. Nutr Hosp. 2015; 31(Supl 1): 68-71.
22. Álvarez G, Pérez J, Tolín M, Sánchez C. Aplicaciones clínicas del empleo de probióticos en pediatría. Nutr Hosp. 2015; 31(Supl 1): 564-574.
23. Pérez J, Taboada L, Tolín M, Sánchez C, Álvarez G. Probioticoterapia en el cólico del lactante: caso clínico. Nutr Hosp. 2015; 31(Supl 1): 78-82.
24. Goldenberg J, Ma S, Saxton J, Martzen M, Vandvik P, Thorlund K, et al. Probióticos para la prevención de la diarrea asociada a Clostridium difficile en adultos y niños. Cochrane Database Syst Rev. 2013; 5: CD006095. DOI: 10.1002/14651858.CD006095
25. Pérez C. Probióticos en la diarrea aguda y asociada al uso de antibióticos en pediatría. Nutr Hosp. 2015; 31(Supl 1): 64-67.
26. Rodríguez A. Probióticos en pediatría. Trastornos funcionales digestivos. VII Workshop 2016. Probióticos, Prebióticos y Salud. Evidencia Científica. SEPyP (Sociedad Española de Probióticos y Prebióticos), 24. Disponible en: http://www.sepyp.es/es/workshop2016/recopilatorio
27. Borruel N. Probióticos y prebióticos en la enfermedad inflamatoria intestinal. Gastroenterol Hepatol. 2007; 30(7): 419-425.
28. Prados-Bo A, Gómez-Martínez S, Nova E, Marcos A. El papel de los probióticos en el manejo de la obesidad. Nutr Hosp. 2015; 31(Supl 1): 10-18.
29. Schwenger E, Tejani A, Loewen P. Probióticos para la prevención de infecciones urinarias en adultos y niños. Cochrane Database Syst Rev. 2015; 12: CD008772. DOI: 10.1002/14651858.CD008772
30. Bo L, Li J, Tao T, Bai Y, Ye X, Hotchkiss R, et al. Probióticos para la prevención de la neumonía asociada al respirador. Cochrane Database Syst Rev. 2014; 10: CD009066. DOI: 10.1002/14651858.CD009066
31. Sáez G, Borrego S, Montoro A, Ocete D, Cerdá C. Infecciones quirúrgicas y tiempos. Probióticos, prebióticos y simbióticos. Su utilidad en las infecciones quirúrgicas. Anales R Acad Med Comunitat Valenciana. 2009; 10.