Las indicaciones de la warfarina se han ampliado en los últimos años, a medida que son detectadas nuevas situaciones clínicas que predisponen a sufrir eventos trombóticos.
Este fármaco es un derivado sintético de la cumarina, una sustancia química que se encuentra de forma natural en muchas plantas, en particular en la Asperula odorata. También se encuentra, en menor cantidad, en el regaliz, la lavanda y algunas otras especies. En un principio, la warfarina se comercializó como un raticida, y sigue siendo popular para este fin, aunque se han desarrollado venenos más potentes desde entonces. Unos pocos años después de su introducción, se descubrió que la warfarina era eficaz y relativamente segura para prevenir la trombosis y las embolias (formación anormal y migración de coágulos sanguíneos). Fue aprobada para su uso como medicamento a principios de los años 50, y se ha mantenido popular desde entonces. Es el anticoagulante más recetado en Norteamérica.
La warfarina, y las cumarinas relacionadas disminuyen la coagulación de la sangre mediante la inhibición de la vitamina K epóxido reductasa, una enzima que recicla la vitamina K oxidada a su forma reducida después de que haya participado en la carboxilación de varias proteínas de la coagulación de la sangre, principalmente la protrombina y el factor VII. Por esta razón, los medicamentos de esta clase también se conocen como antagonistas de la vitamina K.
Debido a sus características especiales, tales como: dosis muy variable en cada individuo, estrecho margen entre la dosis eficaz y la tóxica, interacciones con múltiples fármacos, interferencia de su efecto por el alto consumo de vitamina K en la dieta y la posibilidad de que aparezcan reacciones adversas, tanto desde el punto de vista clínico como de laboratorio. El tratamiento anticoagulante con warfarina tiene varias deficiencias, muchos medicamentos de uso común interactúan con la warfarina, así como algunos alimentos, por lo que su actividad tiene que ser supervisada con frecuentes análisis de sangre para garantizar una dosis segura.
A pesar de sus numerosas desventajas y de tener más de 50 años de uso clínico, la warfarina no ha sido sustituida hasta la fecha por los anticoagulantes orales de reciente aparición. En el año 1999, la warfarina llegó a ocupar el décimo primer lugar entre los medicamentos de mayor consumo en el mundo.
Un poco de historia
A principios de la década de 1920 se produjo el brote de una enfermedad en el ganado, no reconocida anteriormente, en el norte de Estados Unidos y Canadá. El ganado moría de hemorragias incontrolables por lesiones menores o, a veces, de hemorragias internas sin signos externos de lesión. En 1921, Frank Schofield, un veterinario canadiense, determinó que el ganado estaba ingiriendo una mezcla mohosa hecha de trébol dulce que funcionaba como un potente anticoagulante. En 1929, un veterinario de Dakota del Norte, el doctor Roderick LM demostró que la enfermedad se debía a una falta de funcionamiento de la protrombina.
La identidad de la sustancia anticoagulante en el trébol dulce mohoso siguió siendo un misterio hasta 1940, cuando Karl Paul Link y su laboratorio de químicos, que trabajaban en la Universidad de Wisconsin, aislaron y caracterizaron el agente hemorrágico. Pasaron 5 años hasta que un colaborador de Link, Harold A. Campbell, lograra recuperar 6 mg del anticoagulante cristalino. Otro colaborador de Link, Mark A. Stahmann, se hizo cargo del proyecto e inició la extracción a gran escala, aislando 1,8 g de anticoagulante recristalizado en unos 4 meses. A través de experimentos de degradación, establecieron que el anticoagulante era 3,3'-metilenobis-(4-hidroxicumarina), que más tarde llamaron dicumarol. Confirmaron sus resultados sintetizando dicumarol y demostrando que era idéntico al agente de origen natural. En los siguientes años, se encontraron numerosas sustancias químicas similares con las mismas propiedades anticoagulantes. La primera de estas sustancias en ser comercializada fue el dicumarol, patentado en 1941.
Link siguió trabajando en el desarrollo de anticoagulantes más potentes basados en la cumarina, para su utilización como venenos contra roedores, obteniendo así la warfarina en 1948. El nombre de warfarina se deriva del acrónimo WARF, de Wisconsin Alumni Research Foundation, más la terminación «arina», que indica su relación con la cumarina. La warfarina se registró por primera vez para su uso como raticida en los EE UU en 1948, y enseguida se hizo muy popular. Aunque fue desarrollada por Link, la WARF (Fundación de Investigación de los Alumnos de Wisconsin) apoyó financieramente la investigación y se le asignó la patente.
Después de un incidente en 1951, en el que un soldado del ejército americano intentó suicidarse sin éxito con warfarina y, comenzaron los estudios en el uso de la warfarina como anticoagulante terapéutico. Se encontró que era superior al dicoumarol, y en 1954 fue aprobado su uso médico en humanos. Uno de los primeros famosos que usaron la warfarina fue el presidente de Estados Unidos, Dwight Eisenhower, al que se le recetó después de un ataque al corazón en 1955.
El mecanismo exacto de acción de la warfarina siguió siendo desconocido hasta que, en 1978, se demostró que la warfarina inhibe la enzima epóxido reductasa y, por tanto, interfiere con el metabolismo de la vitamina K.
En el año 2003, se afirma que la warfarina fue la sustancia utilizada por Lavrenty Beria, Nikita Khrushchev, y otros, para envenenar al líder soviético Joseph Stalin. La warfarina es insípida e incolora, y produce síntomas similares a los que provocaron la muerte a Stalin.
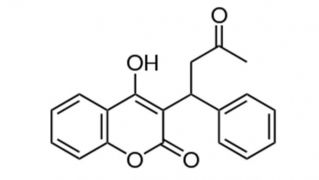
Estereoquímica y farmacocinética
La warfarina es una mezcla racémica de dos isómeros ópticamente activos: las formas R y S. Estos enantiómeros difieren en su potencia anticoagulante, metabolismo, eliminación e interacciones con otros fármacos. Aunque su disponibilidad es completa cuando se administra por vía intravenosa, intramuscular, oral o rectal, sólo la forma oral está disponible para uso clínico. La absorción gastrointestinal es completa, aunque el pico de concentración plasmática suele alcanzarse entre 2 y 8 horas luego de una sola dosis oral.
En el plasma fetal las concentraciones se aproximan a los valores maternos. La vida media plasmática (T½) es muy variable y oscila entre 36 y 42 horas, lo que le proporciona una gran ventaja para el control de su efecto anticoagulante, al compararse con otros derivados cumarínicos cuyas T½ son muy cortas o demasiado largas. La unión a la albúmina plasmática (99%), es la responsable de su larga T½, también difunde muy poco al líquido cefalorraquídeo, orina y leche materna, por lo que puede ser usada sin riesgo durante la lactancia.
La forma S es tres veces más activa que la R, pero es eliminada más rápidamente. Este isómero es metabolizado por las enzimas microsomales hepáticas (citromo P450) a metabolitos hidroxilados inactivos (hidroxicumarinas) que son excretados en la bilis. En cambio, la forma R es metabolizada por enzimas solubles citosólicas y convertida a alcoholes de warfarina, los cuales son excretados en la orina y poseen mínima actividad anticoagulante. Entre las isoenzimas del citocromo P450 involucradas en el metabolismo de la warfarina se incluyen: 2C9, 2C19, 2C8, 2C18, 1A2 y 3A4. La 2C9 probablemente es la principal isoenzima que modula su actividad anticoagulante in vivo. El estudio del metabolismo de los diferentes isómeros alcanza gran importancia cuando se consideran las interacciones con otros fármacos.
Mecanismo de acción
La warfarina inhibe la síntesis de formas biológicamente activas de calcio dependientes de la vitamina K (los factores de coagulación II, VII, IX y X), así como los factores reguladores de proteína C, proteína S y proteína Z. También pueden verse afectadas otras proteínas que no participan en la coagulación de la sangre, como la osteocalcina o las proteínas G.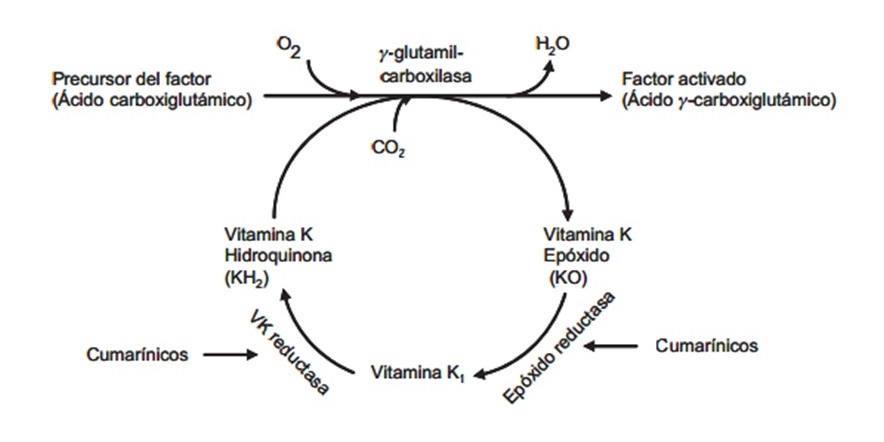 Los precursores de estos factores requieren de la carboxilación de sus residuos de ácido glutámico para permitir a los factores de coagulación que se unan a las superficies fosfolipídicas dentro de los vasos sanguíneos, en el endotelio vascular. La enzima que lleva a cabo la carboxilación del ácido glutámico es la gamma-glutamil carboxilasa. La reacción de carboxilación se producirá sólo si la enzima carboxilasa es capaz de convertir al mismo tiempo una forma reducida de la vitamina K (la hidroquinona) en époxido de vitamina K. El epóxido de vitamina K es reciclado de vuelta, a su vez, produciéndose vitamina K e hidroquinona mediante otra enzima (la vitamina K epóxido reductasa, o VKOR). La warfarina inhibe a la epóxido reductasa (concretamente a la subunidad VKORC1), por lo que disminuye la vitamina K y la hidroquinona en los tejidos, lo cual inhibe la actividad de carboxilación de la glutamil carboxilasa. Cuando esto ocurre, los factores de coagulación ya no son carboxilados de nuevo, y son incapaces de enlazarse a la superficie endotelial de los vasos sanguíneos, y por lo tanto son biológicamente inactivos. Cuando se degradan las reservas de factores activos previamente producidos (durante varios días) y se sustituyen por factores inactivos, el efecto anticoagulante se hace evidente. Los factores de coagulación se producen, pero tienen una funcionalidad disminuida debido a la subcarboxilación. Estos factores con falta de carboxilación son denominados colectivamente PIVKAs (proteínas inducidas por ausencia/antagonismo de vitamina K), y los factores de coagulación como PIVKA-x (por ejemplo, factor PIVKA-II). El resultado final es, por lo tanto, disminuir la coagulación de la sangre en el paciente.
Los precursores de estos factores requieren de la carboxilación de sus residuos de ácido glutámico para permitir a los factores de coagulación que se unan a las superficies fosfolipídicas dentro de los vasos sanguíneos, en el endotelio vascular. La enzima que lleva a cabo la carboxilación del ácido glutámico es la gamma-glutamil carboxilasa. La reacción de carboxilación se producirá sólo si la enzima carboxilasa es capaz de convertir al mismo tiempo una forma reducida de la vitamina K (la hidroquinona) en époxido de vitamina K. El epóxido de vitamina K es reciclado de vuelta, a su vez, produciéndose vitamina K e hidroquinona mediante otra enzima (la vitamina K epóxido reductasa, o VKOR). La warfarina inhibe a la epóxido reductasa (concretamente a la subunidad VKORC1), por lo que disminuye la vitamina K y la hidroquinona en los tejidos, lo cual inhibe la actividad de carboxilación de la glutamil carboxilasa. Cuando esto ocurre, los factores de coagulación ya no son carboxilados de nuevo, y son incapaces de enlazarse a la superficie endotelial de los vasos sanguíneos, y por lo tanto son biológicamente inactivos. Cuando se degradan las reservas de factores activos previamente producidos (durante varios días) y se sustituyen por factores inactivos, el efecto anticoagulante se hace evidente. Los factores de coagulación se producen, pero tienen una funcionalidad disminuida debido a la subcarboxilación. Estos factores con falta de carboxilación son denominados colectivamente PIVKAs (proteínas inducidas por ausencia/antagonismo de vitamina K), y los factores de coagulación como PIVKA-x (por ejemplo, factor PIVKA-II). El resultado final es, por lo tanto, disminuir la coagulación de la sangre en el paciente.
El efecto inicial de la administración de warfarina promueve brevemente la formación de coágulos. Esto se debe a que el nivel de proteína S también depende de la actividad de la vitamina K. Los niveles reducidos de proteína S dan lugar a una reducción de la actividad de la proteína C (de la que es cofactor) y, por tanto, se retrasa la degradación del factor Va y el factor VIIIa. Esto hace que el sistema de hemostasia quede temporalmente sesgado hacia la formación de trombos, lo que conduce a un estado protrombótico. Debido a esto, es beneficioso administrar antes heparina, un anticoagulante que actúa sobre la antitrombina y ayuda a reducir el riesgo de trombosis.
Informacion general
Indicaciones terapéuticas
Profilaxis y/o tratamiento de trombosis venosas, embolismo pulmonar, Profilaxis y/o tratamiento de complicaciones tromboembólicas asociadas con fibrilación auricular y/o sustitución de válvulas cardiacas. Después de un IAM (infarto agudo de miocardio) reduce el riesgo de muerte por infarto de miocardio recurrente o por episodios tromboembólicos como ictus o embolización sistémica.
Posología
En general: inicial, 2-5 mg/día; mantenimiento, 2-10 mg/día. Individualizar dosis según el INR (indice internacional normalizado). El INR a alcanzar está entre 2,0-3,5 según patología.
Contraindicaciones
En hipersensibilidad, embarazo, falta de cooperación del enfermo, diátesis hemorrágicas y/o discrasia hemática, lesiones orgánicas susceptibles de sangrar. intervenciones quirúrgicas recientes o previstas en el SNC, operaciones oftalmológicas o que pongan al descubierto grandes superficies de tejidos, úlcera gastroduodenal o hemorragias en tractos gastrointestinal, urogenital o respiratorio, hemorragias cerebrovasculares, pericarditis, derrames pericardiacos, endocarditis lenta. HTA grave; lesiones graves de los parénquimas hepático y renal actividad fibrinolítica aumentada (p. ej., después de operaciones de pulmón, próstata, etc.). Dosis elevadas de AINE, miconazol (vía general y gel bucal), fenilbutazona (vía general), dosis elevadas de AAS y otros salicilatos.
Precauciones
Riesgo de: hemorragias, necrosis (si hay necrosis, sustituir por heparina), liberación de émbolos o placas ateromatosas. I.R. (insuficiencia respiratoria) moderada-grave, I.H.( insuficiecia hepatica) moderada-grave, HTA (hipertension arterial) moderada-grave. Enfermedades infecciosas o alteraciones de la flora intestinal, catéteres, deficiencia en la respuesta anticoagulante mediada por proteína C o su cofactor, proteína S (riesgo de necrosis tisulares), monitorizar el INR. No hay datos que avalen su uso en niños.
Interacciones
Efecto inhibido por:
Inductores enzimáticos (aminoglutetimida, carbamazepina, fenazona, griseofulvina, fenobarbital, secobarbital, rifampicina, H. perforatum), fármacos que reducen su absorción (sucralfato, ácido ascórbico), vitamina K, ginseng, alimentos ricos en vitamina K.
Efecto potenciado por:
– Inhibidores enzimáticos (alopurinol, dextropropoxifeno, tramadol, amiodarona, ciprofloxacino, claritromicina, eritromicina, norfloxacino, ofloxacino, pefloxacino, cloranfenicol, cimetidina, omeprazol, ranitidina, cisaprida, disulfiram, fluvastatina, lovastatina, simvastatina, fluconazol, fluorouracilo, fluoxetina, fluvoxamina, interferón alfa y beta, isoniazida, itraconazol, lornoxicam, metronidazol, saquinavir, tamoxifeno, viloxazina, virus gripales inactivos).
– Fármacos que la desplazan de su unión a proteínas plasmáticas (ác. etacrínico, ác. nalidíxico, diclofenaco, fenilbutazona, feprazona, ibuprofeno, ketoprofeno, ác. mefenámico, sulindaco, benciodarona, bicalutamida, carnitina, gemfibrozilo, hidrato cloral, miconazol, ác. valproico).
– Disminución de disponibilidad de vitamina K (levotiroxina, neomicina, cefamandol, clofibrato, estanozolol).
– Fármacos que disminuyen la síntesis de factores de coagulación (danazol, paracetamol, quinidina, quinina, vitamina E, etanol).
– AAS, diflunisal.
– Doxiciclina, tetraciclina (hipoprotrombinémicas).
– Otros: benzbromarona, propranolol, piracetam.
– Aumenta tiempo de protrombina con: sulfametoxazol, flutamida.
– Disminuye tiempo de protrombina con: clortalidona, espironolactona.
Efecto anticoagulante variable por: anticonceptivos orales, fenitoína, disopiramida, colestiramina.
Embarazo
No se recomienda, atraviesa la placenta. Se han descrito malformaciones congénitas y otros efectos adversos en el desarrollo fetal, incluyendo hipoplasia nasal grave, condrodisplasia punctata, atrofia óptica, microcefalia y retraso mental y del crecimiento en niños nacidos de madres sometidas a esta medicación durante el primer trimestre.
Lactancia
Prácticamente no se detecta warfarina en la leche materna, por tanto no son de temer efectos indeseados en el lactante. Los niños alimentados con leche de madres tratadas con warfarina no sufren cambios en los tiempos de protrombina.
Reacciones adversas
Hemorragias en cualquier órgano.
– En caso de sobredosificación:
Los efectos de la warfarina pueden revertirse con vitamina K, o, cuando es necesaria una rápida reversión (por ejemplo, en caso de hemorragia grave), con un concentrado de complejo de protrombina (que sólo contiene los factores inhibidos por la warfarina), o por vía intravenosa con plasma fresco congelado (dependiendo de la indicación clínica) con vitamina K añadida. Para los pacientes con un INR entre 4,5 y 100, una pequeña dosis oral de vitamina K es suficiente.
Bibliografía
Galeano Ríos, FA. M.D. Revisión. Anticoagulación oral con Warfarina. Volumen 14 Edición 1. Revista Medicina de Caldas.
Quintero-González, JA. Cincuenta años de uso clínico de la warfarina. Invest Clin 51(2): 269 - 287, 2010
http://warfarina.com/historia_de_la_warfarina
http://www.nlm.nih.gov/medlineplus/spanish/druginfo/meds/a682277-es.html
http://www.neumologica.org/Archivos/warfarina.pdf
http://www.vademecum.es/principios-activos-warfarina-b01aa03

