IntroducciónPodría afirmarse que, en los últimos años, en el campo de la alimentación se ha producido una verdadera revolución, de forma que los alimentos de uso corriente, que eran los únicos disponibles hace un siglo, comparten hoy mercado con otro tipo de productos alimenticios que se presentan en diversas formas galénicas (polvos, granulados, cápsulas, comprimidos, ampollas bebibles, emulsiones para administración oral, etc.), para facilitar su conservación y utilización por los consumidores1. Estos preparados van destinados en su mayoría a personas sanas (niños, adultos o ancianos), pero existe también un creciente número de productos destinados a situaciones especiales.
La dispensación de estos preparados alimenticios y el consejo nutricional son algunas de las labores tradicionales de la farmacia. Así, por ejemplo, productos tan emblemáticos en este campo como las leches infantiles, destinadas a sustituir a la lactancia materna cuando ésta no es posible, comenzaron a comercializarse en España en estos establecimientos sanitarios2. También la aparición de alimentos destinados a situaciones especiales está ligada a la farmacia, y fue asimismo en estos establecimientos donde nacieron los complejos vitamínicos que ahora se califican de complementos alimenticios.
Las farmacias no permanecen, ni mucho menos, ajenas a la rápida evolución y creciente importancia que están adquiriendo los complementos alimenticios en nuestra sociedad, por lo que éstos ocupan cada vez más espacio en estos establecimientos. Así, y según los datos facilitados por el Consejo General de Colegios Oficiales de Farmacéuticos, entre los años 2006 y 2009 los alimentos pasaron de ser el 8,75% a ser el 10,04% de los productos de parafarmacia codificados2. Los complementos alimenticios suponían ya entonces más del doble que los alimentos infantiles1, y son cada vez más numerosos, al tiempo que se incrementa progresivamente su demanda debido a la creciente publicidad en los medios de comunicación3.
 Características generales de los productos alimenticios
Características generales de los productos alimenticios
Según el Código Alimentario Español, se consideran alimentos todas las sustancias o productos de cualquier naturaleza (sólidos o líquidos, naturales o transformados) que, por sus características, aplicaciones, componentes, preparación y estado de conservación, sean susceptibles de ser utilizados para la normal nutrición humana, como fruitivos o como productos dietéticos en casos especiales4.
Todos los tipos de alimentos deben incluir en su etiquetado5:
• La denominación del producto.
• La lista de ingredientes.
• La cantidad de los ingredientes que se destaquen en su denominación o en el etiquetado.
• La cantidad neta (en mL, cL, dL o L para los líquidos y en g o kg para el resto).
• La fecha de duración mínima o la de caducidad. La fecha de duración mínima se consigna con las leyendas «consumir preferentemente antes de [día]» o «consumir preferentemente antes del fin de…»; no es obligatoria en chicles ni caramelos que contengan casi exclusivamente azúcar aromatizado.
• Las condiciones especiales de conservación y de utilización.
• El modo de empleo, cuando su indicación sea necesaria para su uso adecuado.
• La identificación y domicilio del fabricante o comercializador radicado en la Unión Europea (UE).
• El lote.
• El lugar de origen o procedencia, si procede de fuera de la UE. También es obligatorio consignarlo si procede de la UE en productos cuya omisión del origen pudiera llevar a engaño, pero ese tipo de situaciones no suelen presentarse en los que se comercializan en el canal farmacéutico. Por otra parte, puede no incluirse la referencia del país de origen aunque venga de fuera de la UE si existe un tratado internacional con el país en cuestión.
• Además, se exige que el etiquetado no induzca a error sobre las características del producto5:
– Atribuyéndole propiedades que no posea.
– Sugiriendo que tiene características particulares cuando todos los productos similares tengan dichas características.
– Atribuyéndole propiedades preventivas, terapéuticas o curativas de una enfermedad (salvo cuando proceda en los productos destinados a alimentación especial).
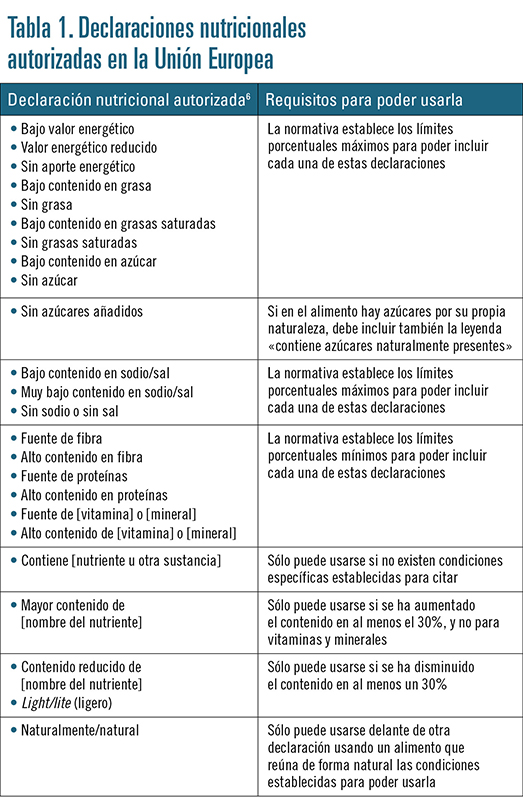 Por su parte, la normativa europea también regula las propiedades nutricionales y las relacionadas con la salud que pueden atribuirse a los componentes de los alimentos6. El reglamento aplicable contempla que las propiedades que se declaren deben estar establecidas mediante datos científicos, y especifica que:
Por su parte, la normativa europea también regula las propiedades nutricionales y las relacionadas con la salud que pueden atribuirse a los componentes de los alimentos6. El reglamento aplicable contempla que las propiedades que se declaren deben estar establecidas mediante datos científicos, y especifica que:
• Sólo se aceptan determinadas declaraciones nutricionales, y establece las condiciones para que puedan utilizarse (tabla 1).
• Sólo pueden hacerse declaraciones comparativas con alimentos de la misma categoría.
En cuanto a las declaraciones saludables, también se establece un listado de las autorizadas y sus requisitos, así como los mecanismos para que pueda solicitarse el uso de una nueva declaración6.
Tipos de alimentos que suelen encontrarse en las farmacias2
Aunque cuando las aguas mineromedicinales comenzaron a envasarse se comercializaban a través de las farmacias, actualmente no es habitual encontrarlas en estos establecimientos, a pesar de que no existe ninguna norma estatal que prohíba su venta en farmacias.
Tampoco existe una norma que impida la comercialización a través del canal farmacia de los alimentos de uso común, y de hecho algunos productos que están presentes en todas las farmacias (p. ej., los chicles y las pastillas para chupar) tienen esta consideración. Sin embargo, como ya hemos indicado, el grupo más numeroso entre los tipos de alimentos que se encuentran habitualmente en la farmacia es el de los «complementos alimenticios».
Otro conjunto importante lo constituyen los «preparados alimenticios para regímenes dietéticos y/o especiales», entre los que se encuentran los destinados a lactantes, embarazadas, deportistas, personas mayores, etc.7.
Dentro de los preparados para regímenes especiales hay dos grupos con características particulares: los productos destinados a ser usados en «dietas para reducción de peso», y los destinados a «usos médicos especiales», que, como veremos, están regulados por sus propias normativas8,9.
También suelen encontrarse en las farmacias plantas medicinales que están comercializadas como alimentos, en vez de estarlo como medicamentos de fabricación industral o medicamentos tradicionales a base de plantas (MTP), que están sometidos a una regulación más estricta10.
A diferencia de lo que ocurre con los medicamentos, la normativa legal no contempla que estos productos tengan que registrarse ni que se les adjudique un código nacional. Sin embargo, el Consejo General de Colegios Oficiales de Farmacéuticos adjudica códigos nacionales de parafarmacia para facilitar la gestión de estos productos en el canal farmacéutico11.
Dado que, como ya hemos comentado, son los preparados más habituales en la farmacia, en este primer tema del curso vamos a centrarnos en los complementos alimenticios. El segundo lo dedicaremos el resto de productos, y también ofreceremos una serie de recomendaciones generales o puntos clave que los farmacéuticos deben tener en cuenta para todos los preparados alimenticios.
Complementos alimenticios
Son productos alimenticios destinados a complementar la dieta normal; consisten en fuentes concentradas de nutrientes o de otras sustancias con efecto nutricional o fisiológico (en forma simple o combinada), y están comercializados en forma dosificada, es decir, en cápsulas, pastillas, tabletas, píldoras u otras formas similares, o en bolsitas de polvos, ampollas de líquido, botellas con cuentagotas y otras formas similares de líquidos y polvos que deben tomarse en pequeñas cantidades unitarias12.
Por sus presentaciones, los complementos alimenticios se asemejan físicamente a los medicamentos, y de hecho algunos de ellos anteriormente estaban registrados como tales. En algunos casos tienen también una composición similar a los medicamentos, e incluso a menudo utilizan similares alegaciones publicitarias3.
Sin embargo, su regulación es muy diferente, tanto en lo que se refiere a su fabricación y puesta en mercado, como a la promoción entre los potenciales consumidores.
Dado que no existe un registro previo a su comercialización ni se realizan por parte de las autoridades sanitarias los controles que caracterizan a los medicamentos, la responsabilidad sobre la calidad del producto recae exclusivamente sobre el fabricante. Es fundamental que los farmacéuticos sean conscientes de esta situación, ya que son ellos quienes deben, basándose en criterios profesionales, seleccionar cuidadosamente los productos que introducen en su farmacia, para evitar no sólo los que no cumplan la normativa vigente, sino también los que no aporten la calidad suficiente o aquellos a los que se atribuyan propiedades basadas en afirmaciones carentes de rigor científico13.
Para poder realizar dicha selección, el primer requisito es conocer la normativa aplicable, que se recoge en el Real Decreto 1487/2009, y el segundo tener una buena formación –basada en la evidencia científica disponible– sobre este tipo de productos3.
 Componentes de los complementos alimenticios
Componentes de los complementos alimenticios
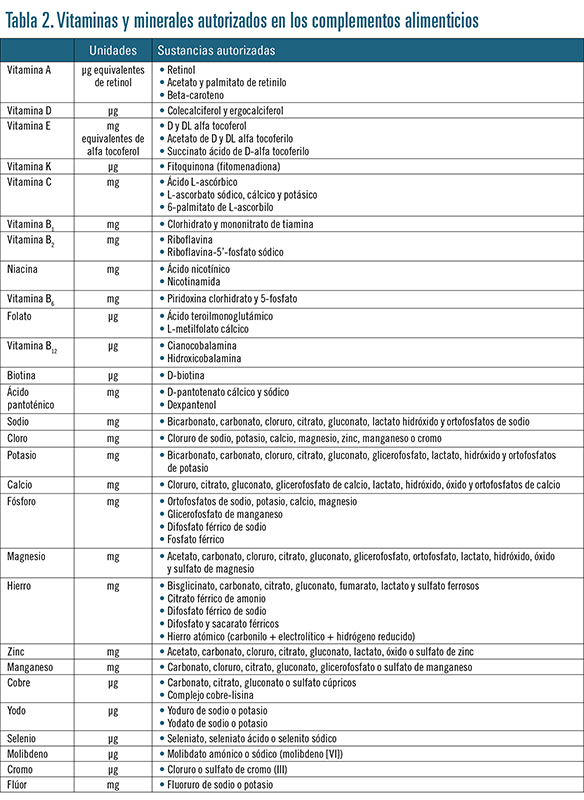
Como se deduce de la propia definición y se detalla en el RD 1487/200912, los complementos alimenticios están constituidos por vitaminas, minerales y otras sustancias con efecto nutricional o fisiológico.
La normativa especifica claramente cuáles son las vitaminas y minerales que pueden formar parte de estos productos, detallando incluso en qué unidades se expresan y qué sales pueden emplearse (tabla 2)12.
Sin embargo, a diferencia de lo que sucede en países como Bélgica, Dinamarca o Italia14, en España no hay regulación sobre el resto de sustancias con efecto fisiológico que pueden formar parte de estos complementos.
Además de los nutrientes, que nuestro organismo precisa para el crecimiento y mantenimiento de sus funciones, muchos alimentos contienen otras sustancias en cantidades muy pequeñas que ayudan a ciertas funciones corporales15. Por ello, la normativa europea reconoce que existe una amplia gama de nutrientes y otros elementos que pueden estar presentes en los complementos alimenticios, incluyendo diversas plantas y extractos de hierbas, para los que convendría adoptar normas cuando se utilicen como ingredientes de complementos alimenticios16.
Sin embargo, resulta paradójico que lo que se encuentre regulado sean las sustancias de actividad bien conocida, y que se deje a criterio de los propios fabricantes la inclusión del resto de «sustancias con actividad nutricional o fisiológica», sin establecer ni siquiera un listado de componentes admitidos o prohibidos3.
Como ya hemos mencionado, sí existe un control sobre las propiedades saludables que pueden atribuirse a una determinada sustancia, basado en el Reglamento 1924/20066, pero la aprobación de una declaración de propiedades saludables no garantiza que su consumo sea seguro, ya que la European Food Safety Authority (EFSA) únicamente valora si existe relación entre la ingesta de una determinada cantidad de esa sustancia y el efecto que se le atribuye14.
Requisitos para su puesta en el mercado
Como ya se ha comentado, no existe un requisto de autorización previa, de manera que para comercializar un complemento alimenticio la empresa responsable únicamente está obligada a notificar su puesta en el mercado nacional a las autoridades competentes (las comunidades autónomas o, en el caso de empresas no radicadas en España, la Agencia Española de Consumo, Seguridad Alimentaria y Nutrición [AECOSAN]), enviando un ejemplar de la etiqueta del producto. Además, esta notificación no es obligatorio hacerla previamente, sino que puede realizarse incluso el mismo día en que se inicie su comercialización.
La AECOSAN puede suspender provisionalmente la comercialización de un producto si considera que su empleo pone en peligro la salud de las personas, y en ese caso está obligada a comunicarlo tanto a la Comisión Europea como a los demás Estados miembros.
La ausencia de un requisito de autorización previa supone que, a diferencia de los medicamentos, en los complementos alimenticios las autoridades sanitarias no realizan ninguna evaluación de eficacia, seguridad y calidad antes de que el producto sea puesto a disposición de los consumidores. Además, la inexistencia de un plazo entre la comunicación de puesta en el mercado y la comercialización efectiva implica que ni siquiera se garantiza que se haya controlado por ninguna entidad ajena a la empresa comercializadora el cumplimiento de la normativa de etiquetado3.
Sin embargo, muchos consumidores tienen la percepción de que los complementos alimenticios constituyen una alternativa más saludable y segura que los medicamentos, sobre todo si entre sus componentes hay alguna planta medicinal17. La realidad es que las garantías sobre su seguridad y eficacia son mucho menores, al estar excluidos de las estrictas regulaciones que se aplican a los medicamentos; en algunos de ellos incluso se ha detectado que pueden producir graves efectos adversos17 o que contienen sustancias prohibidas18, aunque la mayoría de estos casos no han afectado a productos codificados para su venta en farmacias.
Es fundamental que los farmacéuticos sean conscientes de esas diferencias con los medicamentos a la hora de aconsejar a los usuarios y de ayudarles a seleccionar los productos con más garantías3.
 Etiquetado e información al consumidor
Etiquetado e información al consumidor
Además de las ya citadas normas generales de etiquetado de alimentos, estos productos deben incluir12:
• La denominación «complemento alimenticio».
• La denominación de las categorías de nutrientes o sustancias que caractericen el producto, o una indicación relativa a la naturaleza de dichos nutrientes o sustancias.
• La cantidad de nutrientes o de sustancias con un efecto nutricional o fisiológico contenida en el producto por dosis diaria recomendada. En el caso de las vitaminas y minerales, se consignarán en las unidades reflejadas en la tabla 2 y en porcentaje de los valores de referencia.
• La dosis del producto recomendada para consumo diario.
• La advertencia de no superar la dosis diaria expresamente recomendada.
• La afirmación expresa de que los complementos alimenticios no deben utilizarse como sustituto de una dieta equilibrada.
• La indicación de que el producto se debe mantener fuera del alcance de los niños más pequeños.
Por otra parte, está prohibido12:
• Declarar o sugerir que una dieta equilibrada y variada no aporta las cantidades adecuadas de nutrientes en general.
• Atribuir al producto la capacidad de prevenir, tratar o curar enfermedades.
Aunque algunos productos puedan aportar en sus envases más información de la que figura en la etiqueta (al contrario de lo que sucede con los medicamentos), de los complementos no se elaboran fichas técnicas, y tampoco es obligatorio que dispongan de prospecto para informar a los consumidores de sus posibles reacciones adversas, contraindicaciones o interacciones, aunque contengan sustancias sobre las que exista evidencia científica de ello.
Bibliografía
1. Productos de parafarmacia. En: Manual de farmacia y productos de parafarmacia. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos, 1973. Actualizado en junio de 2007. Disponible en: http://www.portalfarma.com/Carga/REVISTAS/REVISTAS%20DEL%20CONSEJO%20GENERAL/FARMACÉUTICOS%20Nº%20325%20MONOGRÁFICO%20-%20JUNIO%202007/21_productos.pdf (último acceso: marzo de 2016).
2. Revisión. Alimentos. Panorama Actual del Medicamento. 2006; 30(298): 994-1.004.
3. Del Arco J. Complementos alimenticios. Farmacia Profesional. 2010; 24(1): 53-59.
4. Decreto 2484/1967, de 21 de septiembre. Código Alimentario Español. BOE n.º 248, de 17/10/1967 (Texto consolidado). Disponible en: https://www.boe.es/buscar/pdf/1967/BOE-A-1967-16485-consolidado.pdf (último acceso: marzo de 2016).
5. Real Decreto 1334/1999, de 31 de julio, por el que se aprueba la Norma general
de etiquetado, presentación y publicidad de los productos alimenticios. BOE n.º 202, de 24/8/1999 (Texto consolidado). Disponible en: https://www.boe.es/buscar/pdf/1999/BOE-A-1999-17996-consolidado.pdf (último acceso: marzo de 2016).
6. Reglamento (CE) n.º 1924/2006 del Parlamento Europeo y del Consejo, de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos. Diario Oficial de la Unión Europea 30/12/2006. I.404/9-25. Disponible en: http://eurex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2006:404:0009:0025:ES:PDF (último acceso: marzo de 2016).
7. Real Decreto 2685/1976, de 16 de octubre, por el que se aprueba la reglamentación técnico-sanitaria para la elaboración, circulación y comercio de preparados alimenticios para regímenes dietéticos y/o especiales. BOE n.º 284, de 26/11/1976 (Texto consolidado). Disponible en: https://www.boe.es/buscar/pdf/1976/BOE-A-1976-23962-consolidado.pdf (último acceso: marzo de 2016).
8. Real Decreto 1430/1997, de 15 de septiembre, por el que se aprueba la reglamentación técnico-sanitaria específica de los productos alimenticios destinados a ser utilizados en dietas de bajo valor energético para reducción de peso. BOE n.º 229, de 24/09/1997 (Texto consolidado). Disponible en: https://www.boe.es/buscar/pdf/1997/BOE-A-1997-20317-consolidado.pdf (último acceso: marzo de 2016).
9. Real Decreto 1091/2000, de 9 de junio, por el que se aprueba la reglamentación técnico-sanitaria específica de los alimentos dietéticos destinados a usos médicos especiales. BOE nº 139, de 10/6/2000 (Texto consolidado). Disponible en: https://www.boe.es/buscar/pdf/2000/BOE-A-2000-10922-consolidado.pdf (último acceso: marzo 2016).
10. Agencia Española de Medicamentos y Productos Sanitarios. Documento de preguntas y respuestas sobre el Real Decreto 1345/2007. Disponible en: http://www.aemps.gob.es/legislacion/espana/medicamentosUsoHumano/FAQ-RD1345_2007.htm#plantas (último acceso: marzo de 2016).
11. Agencia Española de Consumo, Seguridad Alimentaria y Nutrición. Preguntas frecuentes: ¿los complementos alimenticios tienen un código nacional? Fecha de publicación: 5/01/2012. Disponible en: http://www.aecosan.msssi.gob.es/SIAC-WEB/pregunta.do;jsessionid=hNcPWRmby1R1cgqw7xpTqhJTsZcqNsQ4hKznnQTT518ktZpJyhxS!2003377714?reqCode=retrieve&bean.id=1429 (último acceso: marzo de 2016).
12. Real Decreto 1487/2009, de 26 de septiembre, relativo a los complementos alimenticios. BOE n.º 244, de 9/12/2009. Disponible en: http://www.boe.es/boe/dias/2009/10/09/pdfs/BOE-A-2009-16109.pdf (último acceso: marzo de 2016).
13. Colegio Oficial de Farmacéuticos de Bizkaia. Circular PF 01/01. Bilbao, 15 de febrero de 2001.
14. Farré R, Martín F, Martínez de Victoria E, Ortega T, Picó C, Salas J, et al. Informe del Comité Científico de la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN) sobre condiciones de uso de determinadas sustancias distintas de vitaminas, minerales y plantas para ser empleadas en complementos alimenticios (28 de noviembre de 2012). Disponible en: http://www.aecosan.msssi.gob.es/AECOSAN/docs/documentos/seguridad_alimentaria/evaluacion_riesgos/informes_comite/COMPLEMENTOS_1.pdf (último acceso: marzo de 2016).
15. Sanz B. El variado mundo de los alimentos funcionales, nutracéuticos y suplementos dietéticos. Monografías del Instituto de España. Bioquímica y Fisiopatología de la Nutrición, 2005.
16. Directiva 2002/46/CE del Parlamento Europeo y del Consejo, de 10 de junio de 2002, relativa a la aproximación de las legislaciones de los Estados miembros en materia de complementos alimenticios. Disponible en: http://eur-lex.europa.eu/smartapi/cgi/sga_doc?smartapi!celexplus!prod!DocNumber&lg=es&type_doc=Directive&an_doc=2002&nu_doc=46 (último acceso: marzo de 2016).
17. Stickel F, Shouval D. Hepatotoxicity of herbal and dietary supplements:
an update. Arch Toxicol. 2015; 89(6): 851-855.
18. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Retirada del producto Man Power cápsulas. Nota informativa del 25 de febrero de 2016. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/medIlegales/2016/docs/ICM_MI_01-2016-man-power.pdf (último acceso: marzo de 2016).

