¿Qué es Denosumab?
Denosumab es un anticuerpo monoclonal humano (IgG2). Es el primer inhibidor del ligando del receptor del activador del factor nuclear RANKL (Receptor Activator Nuclear Factor ҡ Ligand). Fue descubierto por la compañía de biotecnología AMGEN®. La aprobación de su comercialización por la Comisión Europea del Medicamento se realizó en 2010. AMGEN® comercializó dos medicamentos que presentaron este mismo principio activo: Xgeva®, usado en la prevención de fracturas y otros problemas óseos causados por tumores sólidos que se diseminan hasta el hueso. También usado en el tratamiento de ciertos pacientes con tumores de hueso (células gigantes) que no pueden extirparse mediante cirugía. Se trata de una solución inyectable por vial liofilizado o polvo de Denosumab, dosis: 120 mg/1 vez cada 4 semanas. Y Prolia®, usado en el tratamiento de la osteoporosis en mujeres posmenopáusicas que tienen un riesgo alto de sufrir fracturas en huesos, y para el tratamiento de la pérdida ósea asociada con la supresión hormonal en hombres con cáncer de próstata. Se trata de una solución inyectable (subcutánea) en jeringa precargada de Denosumab. Su vida plasmática media es de 32 días, tomando como punto de partida la concentración máxima. Su prolongada vida media permite la administración semestral de una dosis de 60 mg.
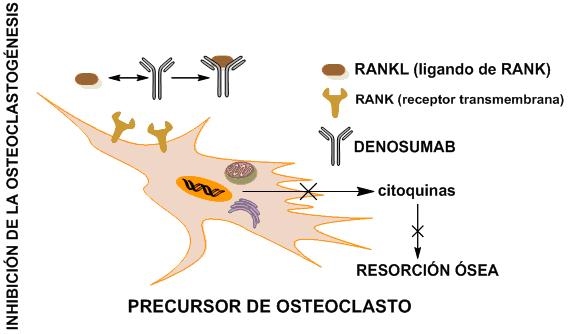 Mecanismo de acción
Mecanismo de acción
Denosumab tiene un mecanismo de acción diferente a otros tratamientos disponibles para la osteoporosis. Es la primera y única terapia aprobada que actúa específicamente sobre el RANK (RANK-L) un regulador esencial de los osteoclastos. Al evitar la interacción RANKL/RANK inhibe la formación, función y supervivencia de los osteoclastos; de este modo, disminuye la resorción ósea y aumenta la masa y fuerza ósea tanto en el hueso cortical como el trabecular.
Ensayos clínicos en mujeres postmenopáusicas
La eficacia de Denosumab en mujeres posmenopáusicas fue estudiada en 4 ensayos clínicos aleatorizados, fase III.
FREEDOM (estudio presentado a la EMA para la autorización en esta indicación)
Este ensayo incluyó 7.868 mujeres entre 60 y 90 años, que fueron aleatorizadas para recibir Denosumab 60 mg o placebo en inyección subcutánea cada seis meses durante tres años. Todos los pacientes recibieron suplementos de calcio y vitamina D. La edad media de las mujeres al inicio era de 72,3 años. El 24% tenían alguna fractura vertebral prevalente al inicio. A los tres años, el 2,3% de las mujeres en el grupo de fármaco activo sufrieron una nueva fractura vertebral en comparación con el 7,2% de los pacientes tratados con placebo. Reducción estadísticamente significativa del 68% de riesgo relativo y casi de un 5% de reducción de riesgo absoluto. Las fracturas vertebrales clínicas se redujeron aproximadamente en la misma medida. En cuanto a los efectos adversos sólo el eccema, la flatulencia y la celulitis fueron más comunes (con significación estadística) en el grupo de Denosumab que en el placebo. Hubo mayor incidencia de infecciones en el grupo con Denosumab, pero sin alcanzar significación estadística.
DEFEND (utilizando como comparador placebo)
Se estudió el efecto en la DMO (densidad mineral ósea) de Denosumab comparado frente a placebo en 332 mujeres posmenopáusicas con osteopenia. A los dos años, Denosumab demuestra un incremento estadísticamente significativo en la DMO frente a placebo.
DECIDE (comparado frente a Alendronato)
Se realizó para determinar si el cambio porcentual medio de DMO en cadera total de mujeres postmenopausicas con baja masa ósea que reciben Denosumab no es inferior al observado en las pacientes que reciben Alendronato. La edad media era de 64 años y el t-score medio en columna lumbar de -2,5DE; el 40% presentaban fractura vertebral prevalente. El resultado que se observe fue que a los 12 meses del estudio las pacientes del grupo de Denosumab aumentaron de manera significativa la DMO en todas las localizaciones medidas. Se produjo una reducción superior de los marcadores de remodelado óseo y ambos grupos presentaron perfiles de seguridad similares.
STAND (comparado frente a Alendronato)
Fue realizado en 504 mujeres post-menopáusicas tratadas previamente durante al menos 6 meses con Alendronato para valorar el efecto del cambio en la DMO en cadera a los 12 meses tras aleatorizarlas a recibir Alendronato (bifosfonato) 70 mg/semana oral o Denosumab 60 mg/6 meses. Denosumab demostró la no inferioridad frente Alendronato en el porcentaje de cambio en la DMO en cadera: 1,90% grupo Denosumab vs 1,05% grupo Alendronato. En el análisis de superioridad, Denosumab mostró ser superior a Alendronato en esta variable. Se desconoce la significación clínica de este hallazgo.
Reacciones adversas
Todos los pacientes tratados con este fármaco deben recibir un aporte adecuado de calcio y vitamina D antes de iniciar el tratamiento y así evitar la hipocalcemia. Pueden sufrir: infecciones cutáneas (celulitis), osteonecrosis mandibular (ONM) en pacientes de riesgo, reacciones alérgicas a la cubierta de la aguja que contiene caucho natural (látex), ciática, cataratas e infecciones del tracto urinario y respiratorio. Y no debe utilizarse en: personas con problemas hereditarios raros de intolerancia a la fructosa, fracturas atípicas de fémur, embarazadas, lactancia y pediatría. Se cree que pueda excretarse por leche materna ya que la ausencia del RANKL (diana del Denosumab) durante el embarazo puede interferir en la maduración de las glándulas mamarias. En estudios preclínicos realizados en ratones knockout carentes de RANK o RANKL, se observó una alteración en la formación de los ganglios linfáticos en el feto.
Bibliografía
1. AMGEN – Spain http://www.amgen.es
2. Ficha técnica de Prolia®. Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_
3. Grupo de trabajo de la Guía de Práctica Clínica sobre Osteoporosis y Prevención de Fracturas por Fragilidad. Guía de
Práctica Clínica sobre Osteoporosis y Prevención de Fracturas por Fragilidad. Plan de Calidad para el Sistema Nacional
de Salud del Ministerio de Sanidad y Política Social. Agència d´Avaluació de Tecnologia i Recerca Mèdiques de Cataluña
(AATRM); 2010. Guías de Práctica Clínica en el SNS: AATRM Nº 2007/02.
4. CHMP assessment report for Prolia. Procedure No. EMEA/H/C/001120. London, 18 March 2010. Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/001120/WC500093529.pdf Ficha técnica de Prolia® FDA.
5. S. Redondo, U. Medina-Moreno, J. Navarro-Dorado, M. Ramajo PhD, T. Tejerina ."Denosumab en el tratamiento de la osteoporosis posmenopáusica y de la pérdida de masa ósea en pacientes con deprivación androgénica". Actualidad en Farmacología y Terapéutica marzo 2012 | volumen 10 nº1.
6. Abad, Mª J. Ariz, A. Azparren, Mª C. Celaya, J. Erviti, J. Garjón, J. Gorricho, A. López, R. Montoya, M. Moreno, L. Muruzabal Informe de evaluación terapéutica, comité de evaluación de nuevos medicamentos, Denosumab.
