El gluten es una proteína amorfa que se encuentra en la semilla de muchos cereales combinada con almidón. Constituye el 80% de las proteínas del trigo y está compuesto de gliadina y glutenina. El gluten es el responsable de la elasticidad de la masa de harina.
La prevalencia estimada de la EC en la población europea es de alrededor del 1%. Un elevado porcentaje de pacientes (75%) está sin diagnosticar debido, en gran parte, a que la EC se ha relacionado durante años exclusivamente con su forma clásica de presentación clínica. Sin embargo, el reconocimiento de otras formas atípicas de manifestarse, oligosintomáticas y asintomáticas, junto con la mayor y mejor utilización de las pruebas complementarias disponibles (serológicas y genéticas), han permitido poner de manifiesto la existencia de diferentes formas de EC. Distinguimos las siguientes:
• Clásica o sintomática. Los pacientes presentan síntomas de malabsorción, con cambios histológicos característicos en la biopsia de intestino delgado y la resolución de la clínica con la retirada del gluten.
• Atípica. Predominan las manifestaciones extradigestivas con pocos o ningún síntoma digestivo. El diagnóstico, como en la forma clásica, se basa en la serología, los hallazgos histológicos y la mejoría de los síntomas tras la eliminación del gluten de la dieta.
• Subclínica o silente. En este caso no existen síntomas ni signos, aunque sí son positivas el resto de las pruebas diagnósticas. Estos casos se diagnostican fundamentalmente entre individuos de los grupos de riesgo.
• Latente. Esta forma corresponde a un grupo de pacientes diagnosticados de EC que en un momento determinado, consumiendo gluten, no presentan síntomas y la mucosa intestinal es normal. Existen dos variantes:
– Tipo A. Pacientes diagnosticados de EC en la infancia que se recuperaron por completo tras el inicio de la dieta sin gluten, permaneciendo en estado subclínico con una dieta normal.
– Tipo B. En este caso, con motivo de un estudio previo, se comprueba que la mucosa intestinal de los pacientes es normal, pero posteriormente desarrollarán la enfermedad.
• Potencial. Estas personas nunca han presentado una biopsia compatible con EC pero, del mismo modo que los grupos anteriores, poseen una predisposición genética determinada por la positividad del HLA-DQ2/DQ8 y un familiar de primer grado con EC. Aunque la serología puede ser negativa, presentan un aumento en el número de linfocitos intraepiteliales (LIE).
Las formas clínicas sintomáticas representan tan sólo la punta del iceberg, cuya base incluiría no sólo las formas silentes, sino también las situaciones denominadas latente y potencial. Todo este espectro clínico quedaría englobado en el término «condición celiaca».
 Epidemiología
Epidemiología
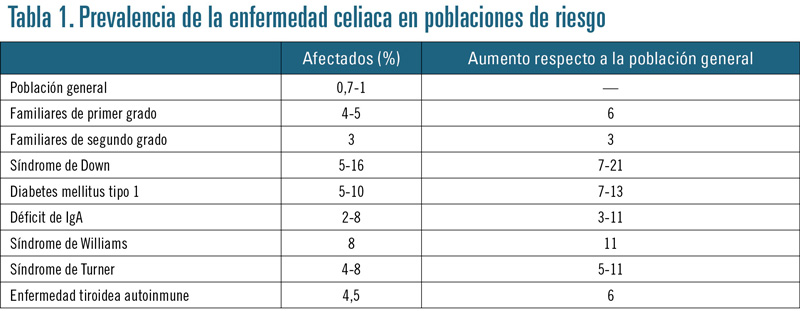
En la población de origen caucasiano (Europa, Estados Unidos) afecta a 1:80-300 niños, casi el doble en las mujeres que en los varones. Los pacientes de otro origen étnico pueden desarrollar también la enfermedad; en algún caso, como ocurre en la población saharaui, afecta hasta a un 5% de la población.
Existen grupos de riesgo en que esta prevalencia es aún superior (tabla 1).
Patogenia
La patogenia de la enfermedad no ha sido claramente establecida, si bien la mayoría de los modelos descritos la consideran una enfermedad inmunitaria en la que concurren factores genéticos y ambientales. La EC es una enfermedad autoinmune desencadenada por un agente ambiental (gluten) en individuos predispuestos genéticamente. Los alelos HLA-DQ2 y/o DQ8 se asocian a un mayor riesgo de padecer la enfermedad. Más del 98% de los pacientes presenta este perfil genético frente a un 40% de la población general.
Entre los factores ambientales se ha especulado sobre el papel desencadenante de las infecciones víricas, mientras que la lactancia materna desempeñaría un papel protector. Algunos estudios recientes sugieren un mayor riesgo relacionado con la incorporación brusca y en cantidades elevadas de gluten en la dieta, así como con la edad de introducción de este componente: la introducción de gluten antes de los 4 meses de edad o la incorporación tardía (después de los 7 meses), especialmente si ya se ha suspendido la lactancia materna, conllevaría un mayor riesgo en la población con susceptibilidad genética.
También la microflora intestinal puede tener un rol importante en la inducción de la tolerancia oral, modulando la respuesta innata para favorecer o no la inflamación (efecto antiinflamatorio o proinflamatorio). Esto ofrecería la posibilidad de condicionar el desarrollo de la inmunidad local y sistémica por medio de determinadas cepas de probióticos utilizados en el tratamiento y la prevención de enfermedades, como la EC.
Manifestaciones clínicas
En las descripciones clásicas de la enfermedad predominaban los síntomas digestivos en edades tempranas. Esta forma de presentación se ha visto desplazada por otras formas atípicas y en edades más tardías. Este cambio puede deberse, en parte, a modificaciones en el patrón de alimentación del lactante –mantenimiento de la lactancia materna, retraso en la introducción del gluten– y, en parte, a la mejora de las técnicas diagnósticas.
Manifestaciones digestivas
Clásicamente, la EC se presentaba en lactantes entre 6 y 24 meses de edad, tras la introducción del gluten en la dieta. Los síntomas más frecuentes eran diarrea, anorexia, distensión abdominal e irritabilidad, que se acompañaban de una escasa ganancia de peso o incluso de una pérdida ponderal. Actualmente las crisis celiacas con consecuencias metabólicas y nutricionales secundarias a la deshidratación son excepcionales.
Manifestaciones extradigestivas
• Crecimiento y desarrollo:
– Talla baja: hasta un 10% de los niños con talla baja idiopática tienen serologías positivas para la celiaquía.
– Pubertad retrasada o alteraciones menstruales en las niñas.
• Síntomas neurológicos o conductuales. La primera manifestación de la enfermedad puede ser, en ocasiones, un síntoma neurológico o una alteración de la conducta. En los niños estas manifestaciones son menos frecuentes, aunque pueden presentar manifestaciones neurológicas subclínicas, algunas de ellas más relacionadas con la desnutrición que con la propia enfermedad, como la hipotonía o el retraso en el desarrollo, mientras que otras pueden tener un origen autoinmune, como en la ataxia cerebelosa.
• Alteraciones del esmalte dentario. Los defectos del esmalte dentario en la dentición permanente del enfermo celiaco se caracterizan por su distribución simétrica y en todos los cuadrantes: manchas, pérdida del brillo y las líneas horizontales, entre otras.
• Osteoporosis y osteopenia, con buena respuesta a la dieta sin gluten.
• Artritis. Un 2,5-5% de los niños o jóvenes con artritis reumatoide juvenil tienen una EC.
• Hepatopatía. Es común una elevación moderada de las transaminasas en el momento del diagnóstico (25-50%), en especial en las formas clásicas, que se normalizan con la retirada del gluten. La EC predispone a la aparición de una enfermedad hepática autoinmune.
• Ferropenia resistente al tratamiento, sobre todo en la población adulta.
• Dermatitis herpetiforme. Es la más común de las manifestaciones cutáneas de la EC. Se caracteriza por lesiones papulovesiculares pruriginosas presentes, de forma simétrica, en la superficie de extensión de los codos, las rodillas, las nalgas, la cara, el cuello, el tronco o la región sacra. En la biopsia de las lesiones se encuentran depósitos de IgA granulares en la membrana subepidérmica.
Enfermedades asociadas
Suelen preceder a la EC, aunque también pueden manifestarse simultáneamente e incluso después de ella. Los pacientes que las padecen se consideran grupos de riesgo, ya que su asociación se produce con una frecuencia superior a la esperada:
• Diabetes mellitus tipo 1.
• Déficit selectivo de IgA.
• Síndrome de Down.
• Tiroiditis autoinmune.
Riesgo de cáncer
La incidencia de cáncer digestivo en pacientes con EC es baja. Se presenta en pacientes con un largo tiempo de evolución de la enfermedad antes del diagnóstico y en pacientes con escasa adherencia a la dieta sin gluten. Es rara su aparición antes de los 50 años de edad. Los 2 tipos más frecuentes son:
• Linfoma no hodgkiniano. El riesgo de desarrollar esta complicación es 2 veces superior al de la población general, igualándose a ésta después de llevar a cabo una dieta exenta de gluten durante 5 años.
• Carcinoma de células escamosas orofaríngeo y esofágico, o adenocarcinoma en el intestino delgado o el recto.
![]() Diagnóstico
Diagnóstico
En general, podemos decir que ante una historia clínica sugestiva se debe comenzar por realizar una evaluación serológica. Los marcadores más sensibles y específicos son la inmunoglobulina A (IgA) antitransglutaminasa (anti-tTG) y los antiendomisio de clase IgA. Los anticuerpos antigliadina tienen una baja sensibilidad y especificidad y han dejado de emplearse (tabla 2). Los nuevos marcadores más sensibles y específicos, como el péptido de gliadina deaminada, tienen también una elevada sensibilidad y especificidad, pero no se usan sistemáticamente.
Los test serológicos son menos precisos antes de los 2 años.
 Identificación de la enfermedad celiaca
Identificación de la enfermedad celiaca
No existen suficientes datos que avalen la necesidad de una búsqueda sistemática de la enfermedad en toda la población, y sólo se debe hacer un cribado en los pacientes con síntomas y signos sugestivos (tabla 3), o en los pertenecientes a alguno de los grupos de riesgo ya citados.
Si el cribado se lleva a cabo en individuos asintomáticos pertenecientes a un grupo de riesgo, debería realizarse a partir de los 3 años de edad y en pacientes que lleven consumiendo gluten al menos durante 1 año. Si los resultados son negativos, deben repetirse las pruebas con cierta periodicidad, o cuando los pacientes presenten síntomas. Otra posibilidad en individuos de riesgo es valorar la presencia de DQ2 o DQ8 en el HLA, evitando la repetición de serologías en los pacientes con resultados negativos para ambos alelos.
Diagnóstico
En los pacientes con anticuerpos IgA anti-tTG o antiendomisio positivos se debe realizar una endoscopia digestiva alta para obtener biopsias intestinales. Las excepciones para no realizar la biopsia son escasas: dermatitis herpetiforme y en sujetos sintomáticos con elevación de anti-tTG 10 veces mayor al límite superior del valor normal (por su concordancia con la presencia de atrofia vellositaria), junto con la existencia de anticuerpos antiendomisio positivos (verificados en una muestra de sangre diferente para evitar falsos positivos) y la presencia del haplotipo HLA DQ2/DQ8. En este caso, el seguimiento de los pacientes debe mostrar una mejoría clínica significativa y una normalización de los valores serológicos tras la retirada del gluten de la dieta.
En todos los demás casos hay que hacer una biopsia intestinal. Se precisa obtener varias biopsias del bulbo duodenal y de la segunda y tercera porción duodenal. Lo ideal es obtener entre 4 y 6 biopsias cada vez.
Los hallazgos histológicos varían desde alteraciones leves –aumento de los linfocitos intraepiteliales– hasta una atrofia vellositaria total, con hiperplasia críptica. En general, los hallazgos histológicos se describen según la clasificación de Marsh:
• Tipo 0 (preinfiltrativo): histológicamente normal, pero con altos títulos de anti-tTG de clase IgA e IgG en las secreciones intestinales (lesión propia de pacientes con EC latente o dermatitis herpetiforme) y <30 linfocitos intraepiteliales por cada 100 enterocitos.
• Tipo 1 (infiltrativa): aumento de LIE con arquitectura vellositaria conservada.
• Tipo 2 (hiperplásica): hiperplasia críptica y aumento de LIE.
• Tipo 3 (destructiva): atrofia vellositaria con hiperplasia críptica. Según el grado de atrofia vellositaria, se subdivide en: a) parcial; b) subtotal, y c) total.
• Tipo 4 (hipoplásica): más de 30 LIE, atrofia vellositaria total e hipoplasia de las criptas.
La provocación no está indicada en la mayoría de los casos de EC; tan sólo se efectuará en los pacientes en que el diagnóstico inicial no fue concluyente. En caso de realizarse, no se hará antes de los 5 años de edad ni durante la pubertad. Siempre se realizará una biopsia intestinal previa para comprobar la normalidad intestinal. La provocación se considera positiva si se detectan anticuerpos positivos y clínica compatible y/o alteraciones histológicas.
Tratamiento de la enfermedad celiaca
No hay tratamiento farmacológico. El tratamiento consiste en el seguimiento de una dieta estricta sin gluten durante toda la vida. Esto conlleva una normalización clínica y funcional, así como la reparación de la lesión vellositaria. Actualmente se dispone de métodos de detección de alta sensibilidad al gluten en los alimentos, que permiten detectar gliadina a partir de 2 partes por millón (ppm). El Codex Alimentario establece como límite máximo de contenido en gluten, para los productos considerados sin gluten, la cifra de 20 ppm, y 200 ppm para los alimentos elaborados con almidón de trigo. La cantidad mínima de gluten necesaria para inducir la aparición de síntomas no está aún del todo clara. La mayoría de los autores están de acuerdo en que las cantidades seguras se encuentran entre 10 y 50 ppm.
Los puntos clave en el tratamiento son los siguientes:
• Educación sobre la enfermedad. Consejo dietético.
• Adherencia a la dieta («para toda la vida»).
• Identificación y corrección de las deficiencias nutricionales.
• Contactar con las asociaciones de enfermos.
• Seguimiento por parte de un equipo con experiencia.
El elemento fundamental es la eliminación del gluten de la dieta. Las fuentes principales de gluten son el trigo, la cebada y el centeno. Existen más dudas respecto a la avena, y algunos autores sugieren que unos consumos inferiores a 40 g/día se toleran bien. Sin embargo, en formas de presentación grave debe recomendarse su eliminación, y también si no es posible garantizar su pureza (que no contenga trazas de otros cereales). El paciente celiaco debe basar su dieta en alimentos naturales (legumbres, carnes, pescados, huevos, frutas, verduras, hortalizas) y cereales sin gluten (arroz y maíz). Deben evitarse, en la medida de lo posible, los alimentos elaborados y/o envasados, ya que en éstos es más difícil garantizar la ausencia de gluten (tablas 4 y 5).
 |
 |
La adherencia a la dieta debe ser estricta. La ingestión de pequeñas cantidades de gluten de una manera continuada puede causar trastornos importantes y no deseables, e incluso un aumento del riesgo de cáncer o de padecer otras enfermedades autoinmunes.
Aunque muchos niños pueden tener osteopenia en el momento del diagnóstico, a los 6-12 meses de seguimiento con dieta la recuperación es lo habitual sin necesidad de suplementos de calcio o vitamina D. Algunos niños pequeños con manifestaciones digestivas graves en el momento del diagnóstico pueden presentar una intolerancia transitoria a la lactosa, que se recupera en pocas semanas o meses tras la retirada del gluten de la dieta.
La mejoría clínica se produce pronto tras la retirada del gluten –en unas 2 semanas– en casi tres cuartas partes de los pacientes, mucho antes que la recuperación histológica.
La monitorización del cumplimiento y de la respuesta a la dieta se realiza mediante anticuerpos específicos (por lo general, anti-tTG), que se repiten cada 6-12 meses. Una falta de negativización o una elevación posterior pueden indicar una trasgresión o una ingestión inadvertida.
En la siguiente dirección de la Sociedad Española de Farmacia Comunitaria puede encontrase un buen documento con consejos para identificar y tratar la celiaquía: https://www.sefac.org/files/documentos_sefac/documentos/F_SEFAC_NoviembreDEFvNOPERS.pdf
Nuevas estrategias terapéuticas
Entre otras alternativas, se barajan las siguientes:
• Búsqueda de una harina de trigo en que la gliadina pierda su inmunogenicidad mediante manipulación genética.
• Enmascarar la capacidad antigénica del gluten antes de que llegue a la mucosa intestinal (prebióticos, enzimas).
• Bloqueadores de la respuesta inmunitaria.
• Modulación de la respuesta inflamatoria.
• Inducción de la tolerancia.
Estrategias de prevención de la enfermedad celiaca
Las estrategias de prevención posibles están enfocadas a las prácticas de alimentación en la primera infancia, fundamentalmente la lactancia materna y el momento y modo de introducir el gluten en la dieta. La lactancia materna y el mantenimiento de la misma en el momento de introducción del gluten son factores de protección en la aparición de EC. La introducción del gluten por debajo de los 4 meses o por encima de los 7 meses se asocia a un riesgo aumentado de padecerla.
Bibliografía
1. Donat Aliaga E, Ribes-Koninckx C, Polanco Allué I. Enfermedad celiaca. En: Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, eds. Tratamiento en gastroenterología, hepatología y nutrición pediátrica, 3.ª ed. Madrid: Ergon, 2012; 123-135.
2. FACE. Cuaderno de la enfermedad celiaca, 2.ª ed. Madrid: IMC. ISBN: 978-84-7867-065-9.
3. Hill D. Management of celiac disease in children. Disponible en: www.uptodate.com [última actualización el 9 de noviembre de 2012].
4. Hill ID, Lee AR. Patient information: celiac disease in children (beyond the basics). Disponible en: www.uptodate.com [última actualización el 3 de diciembre de 2012].
5. Husby S, Koletzko S, Korponay-Szabo IR, Mearin ML, Philips A, Shamir R, et al; the ESPHGAN working Group on Coelic Disease Diagnosis, on behalf of the ESPGHAN Gastroenterology Committee. European Society for Pediatrc Gastroenterology, Hepatology, and Nutrition Guidelines for the Diagnosis of Coeliac Disease. J Pediatr Gastroenterol Nutr. 2012; 54: 136-160.
6. Lindfors K, Lähdeaho ML, Kalliokoski S, Kurppa K, Collin P, Mäki M, et al. Future treatment strategies for celiac disease. Expert Opin Ther Targets. 2012; 16: 665-675.
7. Lionetti E, Castellaneta S, Pulvirenti A, et al. Prevalence and natural history of potential celiac disease in at-family-risk infants prospectively investigated from birth. J Pediatr. 2012; 161: 908-914.
8. Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, et al. The Oslo definitions for coeliac disease and related terms. Gut. 2013; 62: 43-52.
9. Sansotta N, Piacentini GL, Mazzei F, et al. Timing of introduction of solid food and risk of allergic disease development: understanding the evidence. Allergol Immunopathol (Madr). 2012 (en prensa).
10. Sollid LM, Khosla C. Novel therapies for celiac disease. J Intern Med. 2011; 269: 604-613.
11. Guandalini S, Assiri A. Celiac disease: a review. JAMA Pediatr 2014; 168: 272-8.
12. Pengini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV. Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet. Nutrients 2013; 5: 4553-65.

