La conservación adecuada de los medicamentos es un requisito imprescindible para que mantengan sus propiedades fisicoquímicas y farmacológicas; sobre todo si se trata de medicamentos que necesitan condiciones especiales de almacenamiento. El servicio de farmacia tiene la responsabilidad de adaptarse para mantener estas condiciones de conservación1,2.
El objetivo de una buena conservación es mantener la eficacia y mejorar la seguridad, ya que fuera de las condiciones óptimas, los fármacos pueden sufrir una disminución de la potencia y cambios de seguridad por toxicidad de los productos de degradación. Hay distintas variables que cabe considerar para diferentes tipos de conservación: temperatura, luz solar, tipo de envase, medio de dilución, etc.3.
Generalmente los fármacos se almacenan a una temperatura adecuada, estándar y regulada constantemente. Los que necesitan una temperatura inferior se almacenan en neveras de temperatura controlada4; por otra parte, los medicamentos o productos con riesgo de inflamación también son conservados en armarios aislados para evitar la posible propagación del fuego.
Este proyecto se ha centrado en aquellos fármacos a los que les afecta la luz, los denominados fotosensibles. Los medicamentos fotosensibles son un grupo de fármacos que, por sus características, necesitan estar conservados en lugares donde estén protegidos de la luz, para evitar su degradación y/o pérdida de eficacia3. Analizando las variables que intervienen en el proceso de conservación, se ha observado que la protección solar es una de las condiciones que menos se tiene en cuenta durante el proceso de almacenamiento. Uno de los principales motivos podría ser el hecho de que no hay ningún tipo de símbolo o siglas que los identifique, y también porque es en el laboratorio donde se envasa el medicamento de manera responsable y acorde con la información de su fotosensibilidad, hecho que facilita mucho su conservación, ya que no hay que implantar medidas adicionales. Por esta razón, quizás no hay revisiones extensas ni protocolos de procedimientos exhaustivos.
Al considerar el medio hospitalario, observamos que efectivamente todos los comprimidos y viales de medicamentos fotosensibles vienen fotoprotegidos. Pero surge una duda: ¿qué ocurre cuando un fármaco intravenoso tiene que ser diluido para su administración y se envasa en una bomba de infusión?
Se han publicado diferentes revisiones nacionales e internacionales que contemplan listados de medicación fotosensible5-7. Aun así, no se ha encontrado ninguna revisión o protocolo que sea lo suficientemente extenso ni adecuado para cubrir las necesidades del Servicio de Farmacia del Hospital de Mataró. Esta falta de información sobre la estabilidad de fármacos fotosensibles y su importancia para una correcta administración ha constituido la motivación principal para desarrollar este servicio.
Destinatarios del servicio
Este servicio está destinado a distintos tipos de personal sanitario implicados en el circuito del uso de medicacamentos en el hospital.
En primer lugar, este proyecto será de ayuda para el servicio de farmacia. Con la implantación de esta alerta de fotosensibilidad se facilitará la validación farmacéutica de acuerdo con los criterios de seguridad y eficacia. También será facilitada la dispensación controlada para evitar y reducir errores de medicación.
En segundo lugar, serán las enfermeras de planta las que se verán beneficiadas de este proyecto. Con la certeza de tener una alerta para todo principio activo fotosensible, tendrán una confianza mayor en el momento de la preparación y ejecución de la administración.
Por último, será el médico quién podrá prescribir los fármacos con la convicción de que si hay incompatibilidad con la posología, la dilución, el diluyente u otros, habrá una alerta de seguridad que le va a permitir una reevaluación de la prescripción.
Descripción del servicio, plan de actuación
Los objetivos de este proyecto son:
- Identificar los medicamentos inyectables fotosensbiles (de administración en infusión continua o intermitente) más usados, recabar la información e identificar aquellos que están incluidos en la guía farmacoterapéutica del Hospital de Mataró.
- Introducir una notificación en el programa informático de prescripción del hospital que permita generar una alerta cada vez que se prescriba un fármaco fotosensible. Esta alerta ofrecerá una información detallada sobre las condiciones seguras de almacenamiento y administración de cada fármaco en concreto.
Se ha realizado una búsqueda bibliográfica sobre la estabilidad y las condiciones de conservación y administración de los fármacos fotosensibles en el medio hospitalario5-8. De este listado se han excluido las presentaciones de medicamentos que se administran por vía parenteral en forma de inyección directa, o por vía oral, ya que el laboratorio las dispensa en envases adecuados a sus necesidades de almacenamiento (envase opaco, aluminio, etc.).
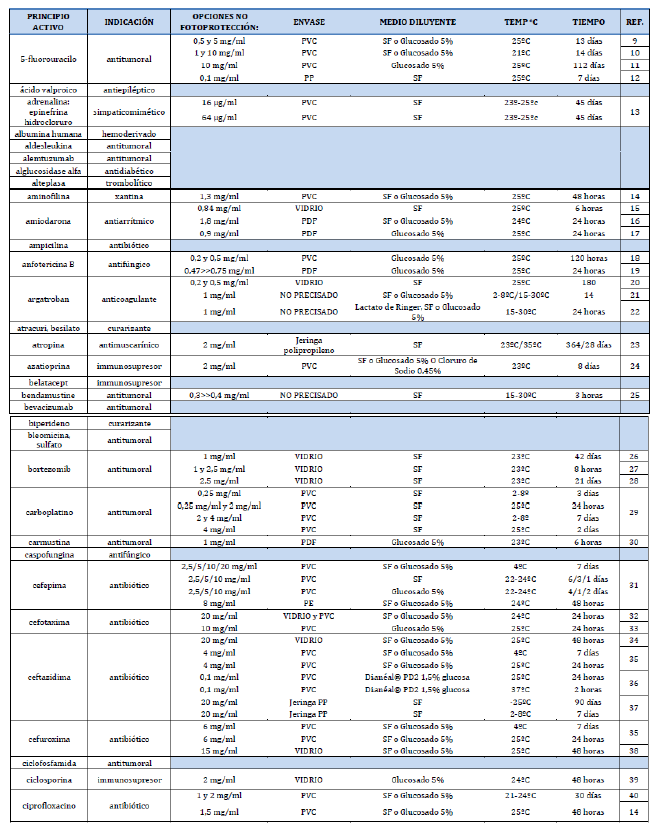
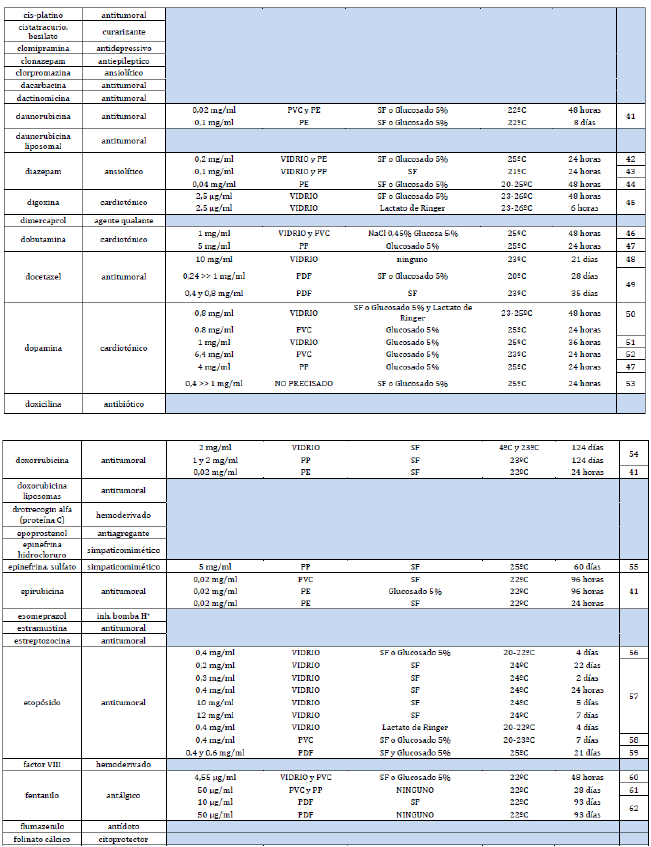
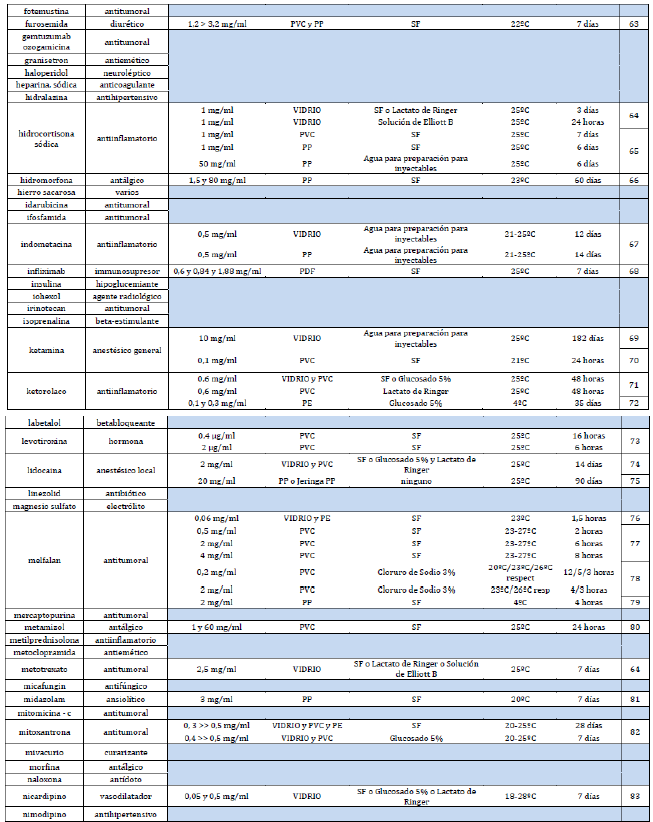
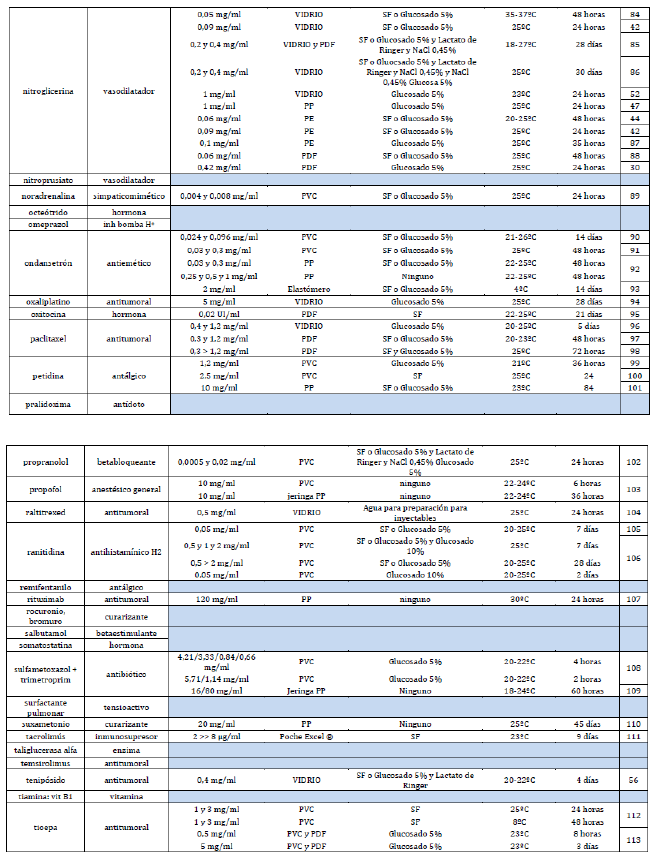
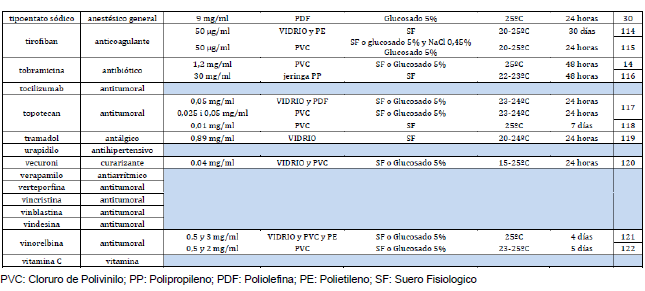
Con la ayuda de la base de datos Stabilis se comprueba que, efectivamente, todos los fármacos tienen un componente fotosensible. Además, se añaden todas las opciones de conservación sin fotoprotección: rango de dosis, envase, diluyente, temperatura, tiempo de estabilidad (anexo 1).
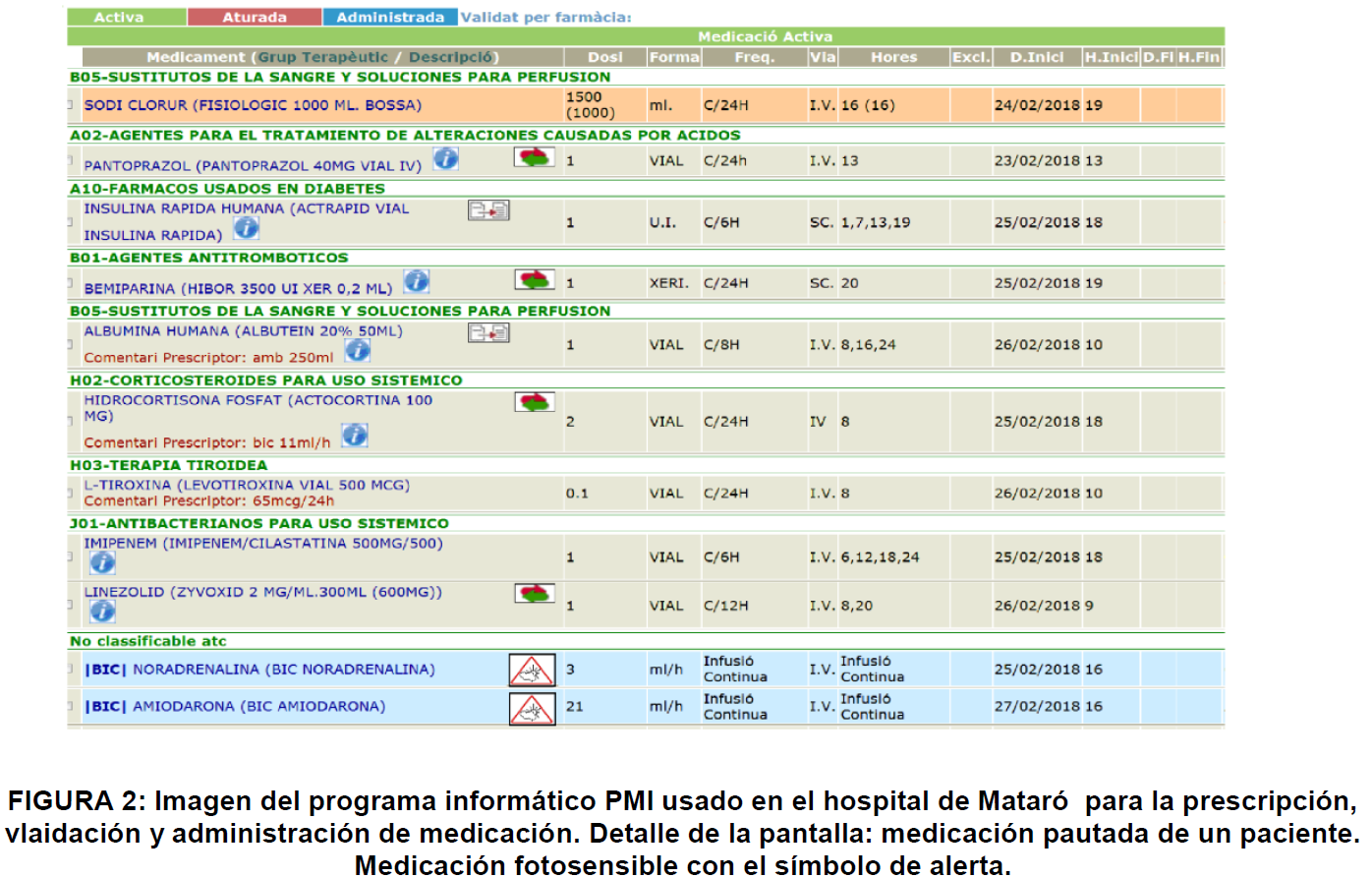
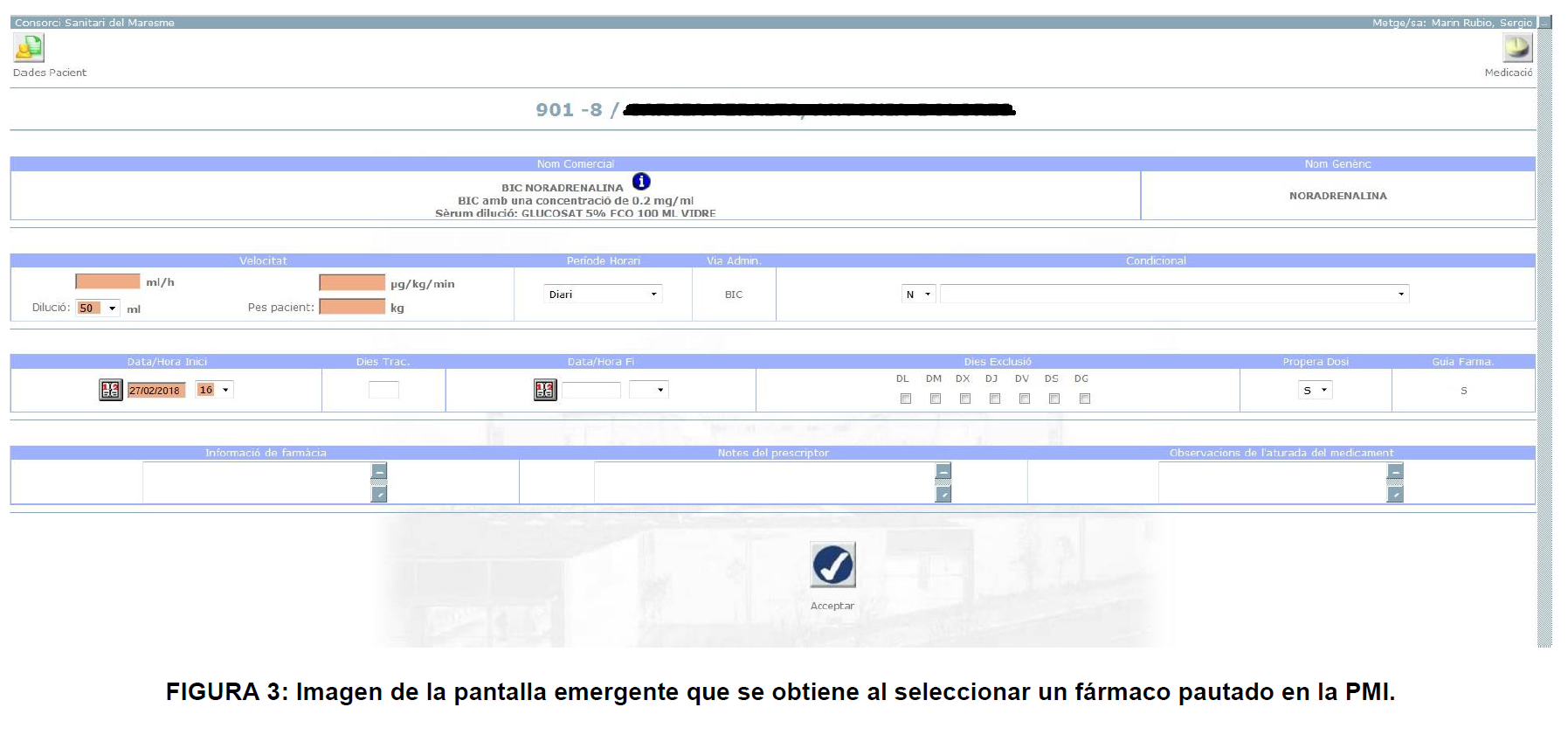
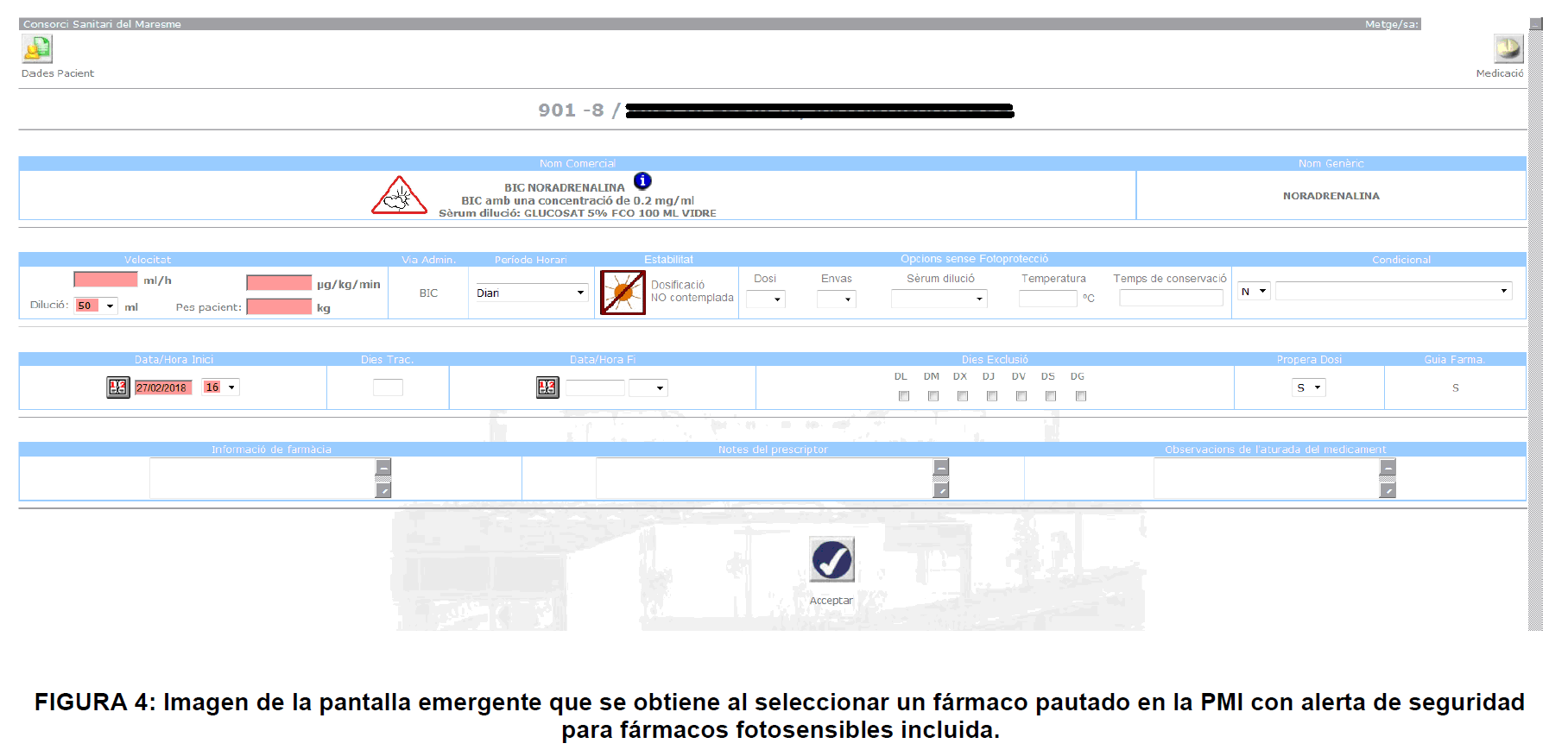
 En la segunda fase del proyecto se debe añadir una notificación en el programa informático usado para la prescripción de fármacos: Prescripción Médica Informatizada® (PMI). Esta notificación genera una alerta para todos los principios activos que hay en el listado efectuado, con todas las consideraciones pertinentes. Esta alerta avisará sobre los fármacos fotosensibles para que se pueda proceder al análisis de su seguridad, considerando el tipo de administración deseada. Se efectuará con un icono de aviso (figura 1).
En la segunda fase del proyecto se debe añadir una notificación en el programa informático usado para la prescripción de fármacos: Prescripción Médica Informatizada® (PMI). Esta notificación genera una alerta para todos los principios activos que hay en el listado efectuado, con todas las consideraciones pertinentes. Esta alerta avisará sobre los fármacos fotosensibles para que se pueda proceder al análisis de su seguridad, considerando el tipo de administración deseada. Se efectuará con un icono de aviso (figura 1).
Además, con la información extraída de Stabilis, se añadirá una pestaña de información, para los fármacos que la tengan, de las condiciones en que se puede evadir la alerta de fotoprotección. Para ello, tendremos que escoger las condiciones dentro de esa pantalla. Primero la dosis, y seguidamente se escogerá el diluyente (si hubiera más de uno) más adecuado (suero fisiológico, glucosado, etc.). Para terminar, habrá una columna con los posibles envases y el tiempo de estabilidad sin fotoprotección que obtenemos.
Al finalizar este proceso aparace una línea de información muy completa, que nos permitirá tomar la decisión.
Tendremos información directa sobre la dosis escogida en un primer momento (necesidad de fotoprotección o no). También podremos observar las distintas posibilidades en los desplegables contiguos. ¿Es suficiente el tiempo de estabilidad para el tipo de administración? Si no lo es, acudiremos a envases fotoprotegidos (figuras 2, 3 y 4).
 |  |  |
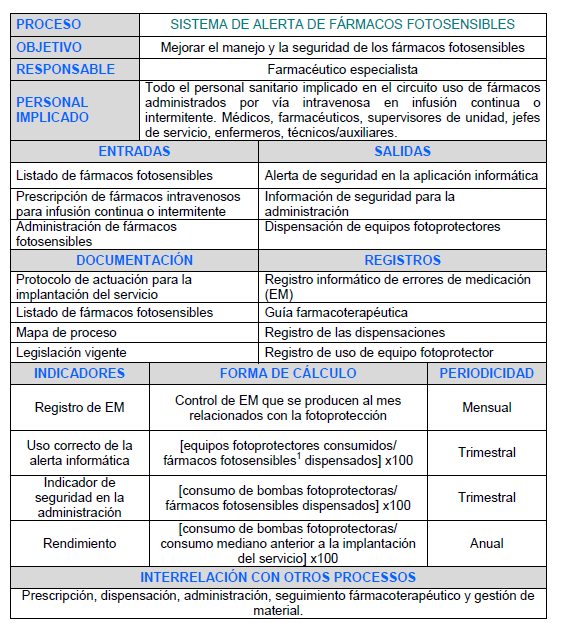
Ficha de proceso
EM: errores de medicación.
*Fármacos fotosensibles sin posibilidad de evadir la fotoprotección o con posibilidad no aplicada.
Valoración económica
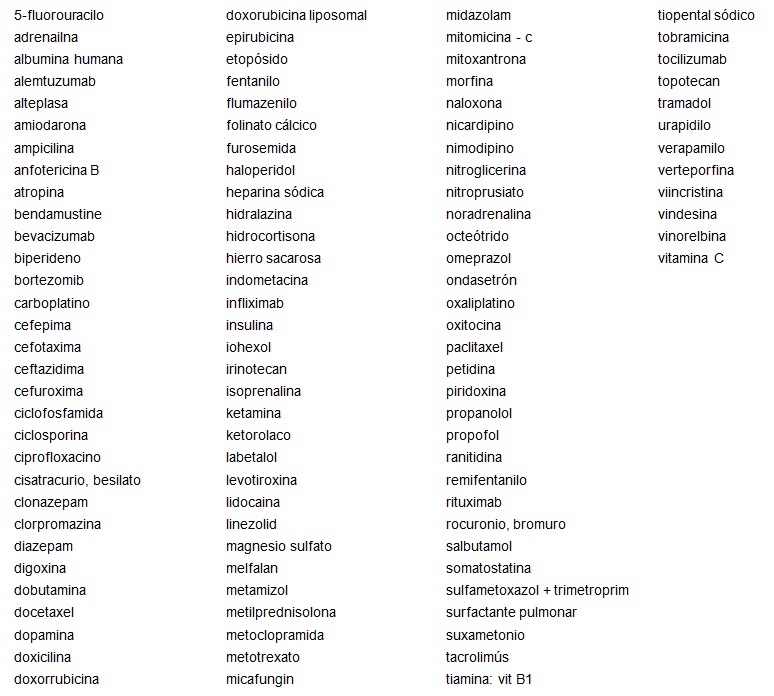
Para la valoración económica de la implantación de este servicio, se ha analizado en primer lugar la lista de los fármacos fotosensibles para encontrar los que están dentro de la guía farmacoterapéutica del hospital. En este caso tenemos un total de 150 fármacos revisados inicialmente, de los que 107 se encuentran en la guía (anexo 2).
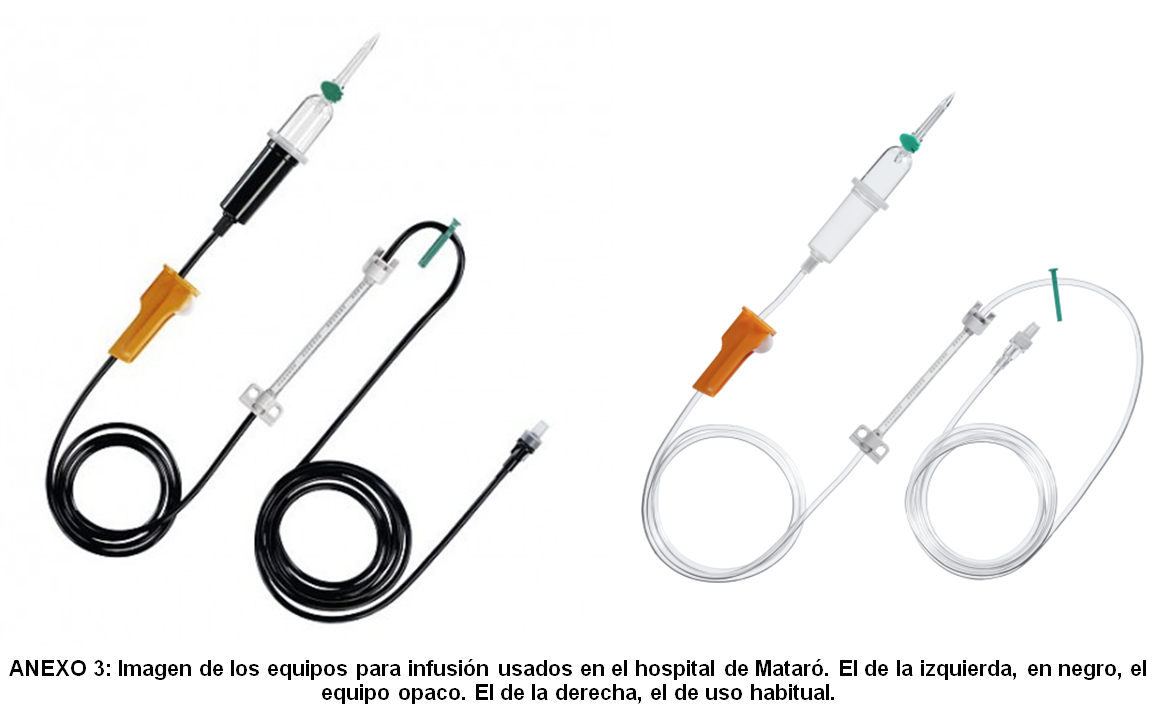
En el Hospital de Mataró se utilizan los equipos de infusión Infusomat® Space Line de BBRAUN®, tanto el fotoprotector (REF 8700125SP) como el estándar (REF8700036SP) (anexo 3) El precio del equipo fotoprotector es de 6,37 €, y el del equipo no fotoprotector de 6,06 €.
Como se puede observar, la diferencia entre las 2 alargaderas es de 31 céntimos de euro. Implantar este servicio costará 0,31 € más por cada equipo dispensado.
Mediante información referente al consumo medio habitual de los medicamentos fotosensibles identificados, se calcula que el aumento del gasto del servicio sería de 91.899,50 € al año.
Valoración del servicio
La implantación de este servicio aporta un nivel de seguridad extra muy importante para el paciente. La alerta implantada en el programa de prescripción y validación de la medicación permite avisar tanto al médico como al farmacéutico y al equipo de enfermería.
Cabe destacar que estos profesionales ya tienen costumbre de observar estos símbolos de alerta, dado que el programa trabaja de esta manera con otros procesos. Además, el desplegable con más información que se genera con la alerta también puede ser de gran ayuda.
Al entrar en el desplegable, se observa claramente si la dosis elegida necesita ser almacenada y protegida de la luz. Asimismo, la alerta también informa de otras dosis, envases y diluyentes en las que el producto sí puede estar en contacto con la luz y la estabilidad obtenida en estas condiciones.
Toda esta información, en un primer instante, permite al médico escoger el producto, la forma de administración, el tiempo de infusión, etc. Y también permite la validación con seguridad del farmacéutico, así como una buena administración por parte del personal de enfermería.
Como punto débil del servicio, hay que considerar siempre el error informático: disponer de sistemas informatizados ahorra mucho tiempo y dinero, pero a veces pueden romperse o fallar. También que tener en cuenta el error humano: en ocasiones, por sobrecarga de trabajo, el equipo hospitalario trabaja más deprisa, lo que puede provocar errores (básicamente pueden producirse por el médico al prescribir, el farmacéutico al validar y el enfermero al administrar). La alerta reduce los 2 primeros pasos pero no hay un sistema de control informático para el equipo en última instancia. Sólo se puede comprobar al comparar el stock con las dispensaciones. Para reducir al máximo este error, los técnicos de farmacia y almacén encargados de suplir el equipo deben asegurar un buen etiquetado y un almacenamiento distintivo.
Reflexiones que compartir
Es importante implantar este servicio de una manera transversal en los distintos equipos implicados, como muchos otros planes de integración de protocolos hospitalarios.
Habrá que empezar por tener el material listo, clasificado y bien etiquetado en cada unidad de enfermería. Se procederá a una reunión de los jefes de servicio para crear un comité de evaluación. Este comité será el encargado de hacer el seguimiento temporal de los indicadores e implantar mejoras o dar explicaciones al personal que lo requiera.
Por último, se redactará una circular informativa y se hará, si fuera necesario, algún tipo de formación a los distintos equipos involucrados.
Más allá de la integración o no de este servicio, la publicación de la información recogida en este trabajo en la Sociedad Española de Farmacia de Hospitalaria (SEFH), puede ser muy interesante y útil para todos los profesionales de este sector.
Respecto a la valoración económica realizada, el coste directo de implantar este servicio es asequible para el presupuesto de un hospital comarcal, como en este caso. Lo que no se puede contabilizar son las partidas o acciones en que de verdad se ahorran costes. Evitar un error de medicación desde la raíz del problema puede suponer muchos beneficios: recortar el tiempo de ingreso, reducir tomas, reducir otros fármacos, etc.
Bibliografía
1. Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios. BOE 178, 27 de julio de 2006. BOE-A-2006-13554.
2. Molero R, Acosta M. Planificación y organización de un servicio de farmacia. Farm Hosp. 2002; 3-28.
3. Tønnesen HH. Phostability of drugs and drug formulations, 2.ª ed. Nueva York: CRC Press, 2004.
4. Cuervas-Mons Vendrell M, Fernández Prieto M, Sánchez Sánchez MT, Maestre Fullana MA, Abad Lecha E, Salvador Palacios A, et al. Posible validez de medicamentos termolábiles fuera de las condiciones de conservación recomendadas por el fabricante. Farm Hosp. 2004; 28(6): 440-444.
5. Sánchez-Quiles I, Nájera-Pérez MD, Espuny-Miró A, Titos-Arcos JC. Revisión de la estabilidad de los medicamentos fotosensibles. Farm Hosp. 2011; 35(4): 204-215.
6. Elcuaz S. Medicamentos fotosensibles. Hospital General La Mancha Centro. Alcázar San Juan [internet], 2012 [consultado el 7 de marzo de 2018]: Disponible en: http://www.serviciofarmaciamanchacentro.es/images/stories/recursos/recursos/docinteres/fotosensibles_julio_2012.pdf
7. University of Illinois at Chicago C DIG. Light-sensitive injectable prescription drugs. Hosp Pharm. 2014; 49(2): 136-163.
8. Sweetman SC. Martindale, guía completa de consulta farmacoterapéutica. 2.ª ed. Londres: Pharmaceutical Press, 2005.
9. Farhang-Asnafi S, Callaert S, Barre J, Tillement JP, Thebault A. Influence of intravenous admixtures on the stability of the new solution of 5-fluorouracil. J Pharm Clin. 1997; 16: 45-48.
10. Martel P, Petit I, Pinguet F, Poujol S, Astre C, Fabbro M. Long-term stability of 5-fluorouracil stored in PVC bags and in ambulatory pump reservoirs. J Pharm Biomed Anal. 1996; 14: 395-399.
11. Quebbeman EJ, Hamid AAR, Hoffman NE, Ausman RK. Stability of fluorouracil in plastic containers used for continuous infusion at home. Am J Hosp Pharm. 1984; 41: 1.153-1.156.
12. Fuhrman LC, Godwin DA, Davis RA. Stability of 5-fluorouracil in an extemporaneously compounded ophtalmic solution. Int J Pharm Compound. 2000; 4: 320-323.
13. Van Matre ET, Ho KC, Lyda C, Fullmer BA, Oldlan AR, Kiser TH. Extended stability of epinephrine hydrochloride injection in polyvinyl chloride bags stored in amber ultraviolet light-blocking bags. Hosp Pharm. 2017; 52(8): 570-573.
14. Goodwin SD, Nix DE, Heyd A, Wilton JH. Compatibility of ciprofloxacin injection with selected drugs and solutions. Am J Hosp Pharm. 1991; 48: 2.166-2.171.
15. Kopelent-Frank H, Schimper A. HPTLC-based stability assay for determination of amiodarone in intravenous admixtures. Pharmazie. 1999; 54: 542-544.
16. Campbell S, Nolan PE, M Bliss, Wood R, Mayersohn M. Stability of amiodarone hydrochloride in admixtures with other injectable drugs. Am J Health Syst Pharm. 1986; 43(4): 917-921.
17. Vieillard V, Appudurai O, Voytenko S, Astier A, Paul M. Stabilité physico-chimique de la suspension d’azacitidine (25 mg/mL) conservée à 4 °C. SFPO Congress Mandelieu, France 2011 [poster].
18. Lee MD, Hess MM, Boucher BA, Apple AM. Stability of amphotericin B in 5% dextrose injection stored at 4 or 25 °C for 120 hours. Am J Hosp Pharm. 1994; 51: 394-396.
19. Kintzel PE, Kennedy PE Stability of amphotericin B in 5% dextrose injection at 25 °C. Am J Hosp Pharm. 1991; 48: 1.681.
20. Klemmer A, Krämer I. Stabilität von Argatroban-Dauerinjektionslösungen in applikationsfertigen Konzentrationen. ADKA Congress, 2011 [póster].
21. Argatroban. Summary of product characteristics. LFB Biomédicaments. 2012.
22. Argatroban. Summary of product characteristics. GlaxoSmithKline. 2008.
23. Donnelly RF, Corman C. Physical compatibility and chemical stability of a concentrated solution of atropine sulfate (2 mg/mL) for use as an antidote in nerve agent casualties. Int J Pharm Compound. 2008; 11(6): 550-552.
24. Johnson CA, Porter WA. Compatibility of azathioprime sodium with intravenous fluids. Am J Hosp Pharm. 1981; 38: 871-875.
25. Bendamustine hydrochloride (Treanda®). Summary of product characteristics. Cephalon. 2008.
26. Walker SE, Milliken D, Law S. Stability of bortezomib reconstituted with 0.9% sodium chloride at 4 °C and room temperature (23 °C). Can J Hosp Pharm. 2008; 61(1): 14-20.
27. Bortezomib (Velcade®). Summary of product characteristics. Janssen-Cilag Ltd. 2016.
28. Walker SE, Charbonneau LF, Law S. Stability of bortezomib 2.5 mg/mL in vials and syringes stored at 4 °C and room temperature (23 °C). J Hosp Pharm. 2014; 67: 102-107.
29. Myer AL, Zhang YP, Kawedia L, Trinh VA, Tran H, Smith JA, et al. Stability study of carboplatin infusion solutions in 0.9% sodium chloride in polyvinyl chloride bags. J Oncol Pharm Pract. 2016; 22: 31-36.
30. Trissel LA, Xu QA, Baker M. Drug compatibility with new polyolefin infusion solution containers. Am J Health-Syst Pharm. 2006; 63: 2.379-2.382.
31. Stewart JT, Maddox FC, Warren FW. Stability of cefepime hydrochloride injection and metronidazole in polyvinyl chloride bags at 4 °C and 22-24 °C. Hosp Pharm. 2000; 35: 1.057-1.064.
32. Foley PT, Bosso JA, Bair JN, Townsend RJ. Compatibility of clindamycin phosphate with cefotaxim sodium or netilmicin sulfate in small-volume admixtures. Am J Hosp Pharm. 1985; 42: 839-843.
33. Barthes D, Fauconneau B, Martin JP, Courtois P. Effects of storage temperature and pH on the stability of cefotaxime in PVC bags. J Pharm Clin. 1989; 8: 101-106.
34. Marble DA, Bosso JA, Townsend RJ. Stability of clindamycin phosphate with aztreonam, ceftazidime sodium, ceftriaxone sodium, or piperacillin sodium in two intravenous solutions. Am J Hosp Pharm. 1986; 43: 1.732-1.736.
35. Faouzi A, Dine T, Luyckx M, Gressier B, Brunet C, Goudaliez F, et al. Stability and compatibility studies of cefaloridine, cefuroxime and ceftazidime with PVC infusion bags. Pharmazie. 1994; 49: 425-427.
36. Manduru M, Fariello A, White RL, Fox JL, Bosso JA. Stability of ceftazidime sodium and teicoplanin sodium in a peritoneal dialysis solution Am J Health-Syst Pharm. 1996; 53: 2.731-2.734.
37. Daul A, Vigneron J, Zenier H, May I, Demoré B. Stability of frozen ceftazidime in polypropylene syringes for intravitreal injection. EAHP Congress. París, 2013 [póster].
38. Marble DA, Bosso JA, Townsend RJ. Compatibility of clindamycin phosphate with aztreonam in polypropylene syringes and with cefoperazone sodium, cefonicid sodium, and cefuroxime sodium in partial-fill glass bottles. Drug Intell Clin Pharm. 1988; 22: 54-57.
39. Shea BF, Ptachcinski RJ, O’Neill S, Cersosimo RJ, Sesin GP, Souney PF. Stability of cyclosporine in 5% dextrose injection. Am J Hosp Pharm. 1989; 46: 2.053-2.055.
40. Donnelly RF. Stability of ciprofloxacin in polyvinylchloride minibags. Can J Hosp Pharm. 2011; 64(4) :252-256.
41. Sautou-Miranda V, Brigas F, Thibault M, Chopineau J. Compatibility of doxorubicin, daunorubicin and epirubicin with low-density polyethylene and polyvinyl chloride, and stability in various conditions of storage. EJHP. 2001; 7(3): 108-115.
42. Yliruusi JK, Sothmann AG, Laine RH, Rajasilta RA, Kristoffersson ER. Sorptive loss of diazepam and nitroglycerin from solutions to three types of containers. Am J Hosp Pharm. 1982; 39: 1.018-1.021.
43. Salomies HEM, Heinonen RM, Toppila MAI. Sorptive loss of diazepam, nitroglycerin and warfarin sodium to polypropylene-lined infusion bags (Softbags). Int J Pharm. 1994; 110: 197-201.
44. Kambia NK, Dine T, Dupin-Spriet T, Gressier B, Luycks M, Goudaliez F, Brunet C. Compatibility of nitroglycerin, diazepam and chlorpromazine with a new multilayer material for infusion containers. J Pharm Biomed Anal. 2005; 37: 259-264.
45. Shank WA, Coupal JJ. Stability of digoxin in common large-volume injections. Am J Hosp Pharm. 1982; 39: 844-846.
46. Kirschenbaum HL, Aronoff W, Piltz GW, Perentesis GP, Cutie AJ. Compatibility and stability of dobutamine hydrochloride with large-volume parenterals and selected additives. Am J Hosp Pharm. 1983; 40: 1.690-1.691.
47. Pramar Y, Das Gupta V, Neal Gardner S, Yau B. Stabilities of dobutamine, dopamine, nitroglycerin and sodium nitroprusside in disposable plastic syringes. J Clin Pharm Ther. 1991; 16: 203-207.
48. Walker S.E, Charbonneau F, Law S. Stability of Docetaxel Solution after Dilution in Ethanol and Storage in Vials and after Dilution in Normal Saline and Storage in Bags. Can J Hosp Pharm. 2007; 60(4): 231-237.
49. Hart MC, Ahmed W. Taxotere 1-vial (docetaxel 20 mg/mL) physical and chemical stability over 28 days in infusion bags containing 0.9% saline solution and 5% glucose solution. EJOP. 2011; 5(1): 24-27.
50. Gardella LA, Zaroslinski JF, Possley LH. Intropin (dopamine hydrochloride) intravenous admixture compatibility (I): stability with common intravenous fluids. Am J Hosp Pharm. 1975; 32: 575-578.
51. Dandurand KR, Stennett DJ. Stability of dopamine hydrochloride exposed to blue-light phototherapy. Am J Hosp Pharm. 1985; 42: 595-597.
52. Peddicord TE, Olsen KM, ZumBrunnen TL, Warner DJ, Webb L. Stability of high-concentration dopamine hydrochloride, norepinephrine bitartrate, epinephrine hydrochloride, and nitroglycerin in 5% dextrose injection. Am J Health-Syst Pharm. 1997; 54: 1.417-1.419.
53. Körner A, Bonnacker I. Stabilität von dopaminhydrochlorid (Dopamine Solvay) in mischungen mit infusionlösungen. Krankenhauspharmazie. 1997; 18: 474-478.
54. Walker S, Lau D, DeAngelis C, Iazetta J, Coons C. Doxorubicin stability in syringes and glass vials and evaluation of chemical contamination. Can J Hosp Pharm. 1991; 44: 71-78.
55. Storms ML, Stewart JT, Warren FW. Stability of ephedrine sulfate at ambient temperature and 4 °C in polypropylene syringes. Int J Pharm Compound. 2001; 5: 394-396.
56. Beijnen JH, Beijnen-Bandhoe U, Dubbelman AC, Van Gijn R, Underberg WJM. Chemical and physical stability of etoposide and teniposide in commonly used infusion fluids. J Parenter Sci Technol. 1991; 45: 108-112.
57. Lepage R, Walker SE, Godin J. Stability and compatibility of etoposide in normal saline. Can J Hosp Pharm. 2000; 53: 338-345.
58. Joel SP, Clark PI, Slevin ML. Stability of the i.v. and oral formulations of etoposide in solution. Cancer Chemother Pharmacol. 1995; 37(1): 117-124.
59. Sadou Yaye H, Rieber Z, HassaniI L, Hoffmann-Martinot C, Babiard M, Aouti H, et al. Pénurie mondiale d’Etopophos et conséquences pratiques: intérêt des études de stabilité dans le choix d’un générique. SFPO Congress. Nantes, 2017 [póster].
60. Kowalski SR, Gourlay GK. Stability of fentanyl citrate in glass and plastic containers and in a patient-controlled delivery system. Am J Hosp Pharm.1990; 47: 1.584-1.587.
61. Donnelly RF. Chemical stability of fentanyl in polypropylene syringes and polyvinylchloride bags. Int J Pharm Compound. 2005; 9: 482-483.
62. Donnelly R F. Stability of fentanyl citrate in polyolefin bags. Int J Pharm Compound. 2016; 20(6): 514-516.
63. Donnelly RF. Chemical stability of furosemide in minibags and polypropylene syringes. Int J Pharm Compound. 2002; 6: 468-470.
64. Cradock JC, Kleinmann LM, Rahman A. Evaluation of some pharmaceutical aspects of intrathecal methotrexate sodium, cytarabine and hydrocortisone sodium succinate. Am J Hosp Pharm 1978; 35: 402-406.
65. Rigge DC, Jones MF. Shelf lives of aseptically prepared medicines. Stability of hydrocortisone sodium succinate in PVC and non-PVC bags and in polypropylene syringes. J Pharm Biomed Anal. 2005; 38: 332-336.
66. Trissel LA, Xu QA. Physical and chemical stability of hydromorphone hydrochloride 1.5 and 80 mg/ml packaged in plastic syringes. Int J Pharm Compound. 2002; 6: 74-76.
67. Walker SE, Gray S, Schmidt B. Stability of reconstituted indomethacin sodium trihydrate in original vials and polypropylene syringes. Am J Health-Syst Pharm. 1998; 55: 154-158.
68. Young BL, Ali Khan M, Chapman TJ, Parry R, Connolly MA, Watts AG. Evaluation of the physicochemical and functional stability of diluted REMSIMA(R) upon extended storage: a study compliant with NHS (UK) guidance. J Pharm Pract and Res. 2015; 496: 421-431.
69. Donnelly RF. Stability of diluted ketamine packaged in glass vials. Can J Hosp Pharm. 2013; 66(3): 198.
70. Lau MH, Hackman C, Morgan DJ. Compatibility of ketamine and morphin injections. Pain. 1998; 75: 389-390.
71. Lor E, Sheybani T, Takagi J. Visual compatibility of fluconazole with commonly used injectable drugs during simulated Y-site administration. Am J Hosp Pharm. 1991; 48: 744-746.
72. Hecq JD, Boitquin L, Lebrun C, Vanbeckbergen D, Evrard JM, Jamart J, Galanti L Freeze thaw treatment of ketorolac tromethamine in 5% dextrose infusion polyolein bags: effect of drug concentration and microwave power on the long-term stability at 4 °C. EJHP Sci. 2006; 12(4): 72-75.
73. Strong DK, Decarie D, Ensom MHH. Stability of levothyroxine in sodium chloride for i.v. administration. Can J Hosp Pharm. 2011; 63(6): 437-443.
74. Kirschenbaum HL, Aronoff W, Perentesis GP, Plitz GW, Cutie AJ. Stability and compatibility of lidocaine hydrochloride with selected large-volume parenterals and drugs additives. Am J Hosp Pharm. 1982; 39: 1.013-1.015.
75. Storms ML, Stewart JT, Warren FW. Stability of lidocaine hydrochloride injection at ambient temperature and 4 °C in polypropylene syringes. Int J Pharm Compound. 2002; 6: 388-390.
76. Beitz C, Einberger C, Wehling M. Stabilität und kompatibilität von zytostatika-zubereitungen mit infusionlösungsbehältern aus polyethylen. Krankenhauspharmazie. 1999; 20: 121-125.
77. Desmaris RP, Mercier L, Paci A. Stability of melphalan in 0.9% sodium chloride solutions prepared in polyvinyl chloride bags for intravenous injection. Drugs RD. 2015; 15: 253-259.
78. Pinguet F, Martel P, Rouanet P, Fabbro M, Astre C. Effect of sodium chloride concentration and temperature on melphalan stability during storage and use. Am J Hosp Pharm. 1994; 51: 2.701-2.704.
79. Vigneron J, Zenier H, May I, Nicolas A. Stabilité du melphalan à 2 mg/mL dans le chlorure de sodium 0,9% dans des conditions pratiques d’utilisation. SFPO Congress. Mandelieu, France, 2013 [poster].
80. Müller HJ, Berg J. Stabilitätsstudie zu metamizol-natrium im PVC-infusionbeutel. Krankenhauspharmazie 1998; 19: 229-234.
81. Peterson GM, Khoo BHC, Galloway JG, Paterson J. A preliminary study of the stability of midazolam in polypropylene syringes. Aust J Hosp Pharm. 1991; 21: 115-118.
82. Stabilité physico-chimique de la gamme oncologie Ebewe Pharma France après dilution. Ebewe Pharma. 2009.
83. Baaske DM, DeMay JF, Latona CA, Mirmira S, Sigvardson KW. Stability of nicardipine hydrochloride in intravenous solutions. Am J Health-Syst Pharm. 1996; 53: 1.701-1.705.
84. Baaske DM, Amann AH, Wagenknecht DM, Mooers M, Carter JE, Hoyt HJ, et al. Nitroglycerin compatibility with intravenous fluid filters containers, and administration sets. Am J Hosp Pharm. 1980; 37: 201-205.
85. Wagenknecht DM, Baaske DM, Alam AS, Carter JE, Shah J. Stability of nitroglycerin solutions in polyolefin and glass containers. Am J Hosp Pharm. 1984;41:1807-1811.
86. D’Arcy PF. Stability of glyceryl trinitrate in plastic and glass containers. Pharm Int. 1985; 6: 7.
87. Hansen HC, Spillum A. Loss of nitroglycerin during passage through two different infusion sets. Act Pharm Nord. 1991; 3(3): 131-136.
88. Macoflex N® Maco Pharma. 2001.
89. Baumgartner TG, Knudsen AK, Dunn AJ, Kilroy RA. Norepinephrine stability in saline solutions. Hosp Pharm. 1988; 23(44): 49-59.
90. Graham CL, Dukes GE, Kao CF, Bertch JM, Hak LJ. Stability of ondansetron in large-volume parenteral solutions. Ann Pharmacotherapy. 1992; 26: 768-771.
91. Bosso JA, Prince RA, Fox JL. Stability of ondansetron hydrochloride in injectable solutions at –20, 5, and 25 °C. Am J Hosp Pharm. 1992; 49: 2.223-2.225.
92. Casto DT. Stability of ondansetron stored in polypropylene syringes. Ann Pharmacotherapy. 1994; 28: 712-714.
93. Jhee SS, Jeong EW, Chin A, Inagaki K, Fox JL, Gill MA. Stability of ondansetron hydrochloride stored in a disposable, elastomeric infusion device at 4 °C. Am J Hosp Pharm. 1993; 50: 1.918-1.920.
94. Stability of oxaliplatin «Ebewe» lyophilisate after reconstitution. Ebewe Pharma. 2007.
95. Kaushal G, Sayre BE, Prettyman T. Stability-indicating HPLC method for the determination of the stability of oxytocin parenteral solutions prepared in polyolefin bags. Drug Discov Ther. 2012; 6(1): 49-54.
96. Sautou-Miranda V, Brigas F, Vanheerswinghels S, Chopineau J. Compatibility of paclitaxel in 5% glucose solution with ECOFLAC® low-density polyethylene containers. Stability under different storage conditions. Int J Pharm. 1999; 178: 77-82.
97. Chin A, Ramakrishnan RR, Yoshimura NN, Jeong EWS, Nii LJ, DiMeglio LS. Paclitaxel stability and compatibility in polyolefin containers. Ann Pharmacother. 1994; 28: 35-36.
98. Paclitaxel. Summary of product characteristics. Hospira UK Limited. 2015.
99. Macias JM, Martin WJ, Lloyd CW. Stability of morphine sulfate and meperidine hydrochloride in a parenteral nutrient formulation. Am J Hosp Pharm. 1985; 42: 1.087-1.094.
100. Grassby PF, Roberts DE. Stability of epidural opiate solutions in 0.9 per cent sodium chloride infusion bags. Int J Pharm Pract. 1995; 3: 174-177.
101. Strong ML, Schaaf LJ, Pankaskie MC, Robinson DH. Shelf-lives and factors affecting the stability of morphine sulphate and meperidine (pethidine) hydrochloride in plastic syringes for use in patient-controlled analgesic devices. J Clin Pharm Ther. 1994; 19: 361-369.
102. Cummings DS, Park MK, Howard B. Compatibility of propranolol hydrochloride injection with intravenous infusion fluids in plastic containers. Am J Hosp Pharm. 1982; 39: 1.685-1.687.
103. Stewart JT, Warren FW, Maddox FC, Viswanathan K, Fox JL. The stability of remifentanil hydrochloride and propofol mixtures in polypropylene syringes and polyvinylchloride bags at 22-24 °C. Anesth Analg. 2000; 90: 1.450-1.451.
104. Raltitrexed (Tomudex®). Summary of product characteristics. Hospira UK Ltd., 2013.
105. Galante LJ, Stewart JT, Warren FW, Johnson SM, Duncan R. Stability of ranitidine hydrochloride at dilute concentration in intravenous infusion fluids at room temperature. Am J Hosp Pharm. 1990; 47: 1.580-1.584.
106. Stewart JT, Warren FW, Johnson SM, Galante LJ. Stability of ranitidine in intravenous admixtures stored frozen, refrigerated, and at room temperature. Am J Hosp Pharm. 1990; 47: 2.043-2.046.
107. Mueller C, Dietel E, Heynen S, Nalenz H, Goldbach P, Mahler H, et al. Physico-chemical stability of mabthera drug-product solution for subcutaneous injection under in-use conditions with different administration materials. Int J Pharm Compound. 2001; 19(3): 261-267.
108. Khaleel I, Tabish R, Zaidi S, Shastri M, Suji Eapen M, Chiau Ming L, et al. Investigations into the physical and chemical stability of concentrated co-trimoxazole intravenous infusions. EJHP. 2017.
109. Kaufman MB, Scavone JM, Foley JJ. Stability of undiluted trimethoprim-sulfamethoxazole for injection in plastic syringes. Am J Hosp Pharm.1992; 49: 2.782-2.783.
110. Storms ML, Stewart JT, Warren FW. Stability of succinylcholine chloride injection at ambient temperature and 4 °C in polypropylene syringes. Int J Pharm Compound. 2003; 7: 68-70.
111. Myers AL, Zhang Y, Kawedia JD, Shank BR, Deaver MA, Kramer MA. Stability of tacrolimus injection diluted in 0.9% sodium chloride injection and stored in Excel bags. Am J Health-Syst Pharm. 2016; 73(24): 2.083-2.088.
112. Murray KM, Erkkila D, Gombotz WR, Pankey S. Stability of thiotepa (lyophilized) in 0.9% sodium chloride injection. Am J Health-Syst Pharm. 1997; 54: 2.588-2.591.
113. Xu QA, Trissel LA, Zhang Y, Martínez JF, Gilbert DL. Stability of thiotepa (lyophilised) in 5% dextrose injection at 4 and 23 °C. Am J Health-Syst Pharm. 1996; 53: 2.728-2.730.
114. Garabito MJ, Jiménez L, Bautista J, Santos-Rubio MD, Pérez Rodrigo I. Stability of tirofiban hydrochloride in 0.9% sodium chloride injection for 30 days. Am J Health-Syst Pharm. 2001; 58: 1.850-1.851.
115. Bergquist PA, Zimmermann J, Kenney RR, Han RYH, Hunke WA. Stability of tirofiban hydrochloride in three commonly used IV solutions and polyvinyl chloride administration sets. Am J Health Syst Pharm. 1999; 56: 1.627-1.629.
116. Zbrozek AS, Marble DA, Bosso JA, Bair JN, Townsend RJ. Compatibility and stability of clindamycin phosphate-aminoglycoside combinations within polypropylene syringes. Drug Intell Clin Pharm. 1987; 21: 806-810.
117. Craig SB, Bhatt UH, Patel K. Stability and compatibility of topotecan hydrochloride for injection with common infusion solutions and containers. J Pharm Biomed Anal. 1997; 16: 199-205.
118. Krämer I, Thiesen J. Pharmazeutische aspekte von topotecan-infusionen. TAP Pharmazeutische Zeitung. 1997; 31: 30-33.
119. Balayssac D, Badaroux L, Rodier C, Sautou-Miranda V, Bazin JE, Chopineau J. Compatibility and stability of parenteral analgesic admixtures for multimodal analgesia EJHP Science. 2009; 15(4): 78-82.
120. Vecuronium (Norcuron®). Summary of product characteristics. Merck Sharp Dohme. 2012.
121. Stability of vinorelbin «Ebewe» infusion solutions. Ebewe Pharma. 2007.
122. Stamatakis MK, Leader G, Tracy TS. Stability of high-dose vancomycin and ceftazidime in peritoneal dialysis solutions. Am J Health Syst Pharm. 1999; 56: 246-248.
Anexo 1. Listado de fármacos fotosensibles. Incluye información de estabilidad para fármacos los que tienen opciones de conservación sin fotoprotección.
 |  |  |  |  |
Anexo 2. Listado de fármacos fotosensibles de la guía farmacoterapéutica del hospital
Anexo 3. Equipos de infusión