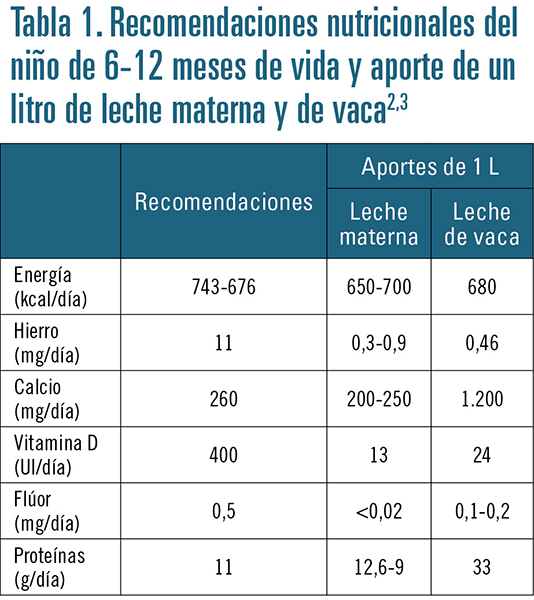
 Los niños alimentados con lactancia materna, total o parcialmente, disponen de un adecuado aporte de nutrientes los primeros 6 meses de vida. Sin embargo, la lactancia materna parece no ser suficiente alimento a partir de los 6 meses, debido a los elevados requerimientos nutricionales del niño, en cuanto a energía, proteína, hierro, cinc, calcio, vitamina A y D y ácidos grasos de cadena larga, principalmente, y tampoco la leche de vaca, por ser deficiente en varios de estos nutrientes y aportar excesiva proteína (tabla 1). Por ello, las directrices pediátricas europeas recomiendan iniciar la alimentación complementaria entre las semanas 17 y 26 después del nacimiento.
Los niños alimentados con lactancia materna, total o parcialmente, disponen de un adecuado aporte de nutrientes los primeros 6 meses de vida. Sin embargo, la lactancia materna parece no ser suficiente alimento a partir de los 6 meses, debido a los elevados requerimientos nutricionales del niño, en cuanto a energía, proteína, hierro, cinc, calcio, vitamina A y D y ácidos grasos de cadena larga, principalmente, y tampoco la leche de vaca, por ser deficiente en varios de estos nutrientes y aportar excesiva proteína (tabla 1). Por ello, las directrices pediátricas europeas recomiendan iniciar la alimentación complementaria entre las semanas 17 y 26 después del nacimiento.
El hierro es uno de los nutrientes más demandados en esta etapa de la vida. Participa en numerosas funciones biológicas, especialmente en el transporte de oxígeno a través de los glóbulos rojos. Su carencia se traduce en anemia, que en los niños pequeños está asociada a un retraso del desarrollo cognitivo. La principal causa de deficiencia de hierro es el aporte insuficiente en la dieta y, en el caso de los recién nacidos, influye también el aporte recibido incluso antes de nacer. Tras el parto, la lactancia materna exclusiva es un excelente modelo de nutrición hasta los 6 meses de vida5-10. Esto se debe a la alta biodisponibilidad del hierro presente en la leche materna (de un 56%, frente a un 30% en la leche de vaca), aunque su contenido sea bajo (0,3-0,9 mg/L)3,11,12. Cabe recordar que el término «biodisponibilidad» hace referencia al porcentaje de hierro de la dieta que es absorbido por el organismo.
No obstante, debe tenerse en cuenta la alta variabilidad en la concentración de hierro presente en la leche materna que hace que no se garanticen, de un modo general, las necesidades de hierro en el niño menor de 6 meses (0,27 mg/día)13. Además, un gran número de factores condicionan un adecuado estado del hierro en el niño de esta edad, como la tasa de crecimiento, las pérdidas de hierro y/o el sexo del recién nacido14.
Durante el periodo de alimentación complementaria, la absorción de hierro es limitada, y está influida por diversos factores, como la naturaleza química y la cantidad de hierro presente en la dieta, la presencia de otros nutrientes o antinutrientes en los alimentos ingeridos, los efectos de las secreciones gastrointestinales y la capacidad de absorción de la mucosa intestinal. Así pues, la biodisponibilidad del hierro es altamente variable. Numerosos estudios afirman que la fortificación de los alimentos infantiles con hierro es una adecuada medida de protección frente a la deficiencia de este mineral15-18. Durante el primer semestre de vida, los niños alimentados exclusivamente con lactancia materna (0,78 L/día) ingieren aproximadamente 0,35 mg de hierro. Los requerimientos de hierro total son de 0,49 mg/día, de los que se absorben 0,03-0,15 mg de hierro, ya que no todo el hierro que está presente en la leche es absorbido y utilizado por el organismo. En este sentido, hay estudios que señalan el papel de la lactoferrina, proteína presente en la leche materna, como favorecedora de la absorción de hierro, mientras que otros estudios realizados en animales de experimentación apuntan a otros factores (p. ej., la α-lactalbúmina) como condicionantes de dicha absorción19. Sin embargo, a partir de los 6 meses, aumenta la prevalencia de ferropenia en el lactante (un 9,6% en lactantes sanos de 12 meses)20, por lo que conviene complementar la lactancia materna con el consumo de alimentos ricos en hierro hemo y el empleo de fórmulas infantiles fortificadas en hierro, con el fin de asegurar un adecuado suministro de este mineral. Las necesidades diarias son de 1 mg/kg/día y las fórmulas infantiles de continuación, junto con los alimentos que se introducen en este periodo, deben aportar el hierro necesario para cubrir dichas necesidades21. Las recomendaciones de ingesta a partir de los 6 meses son de 11 mg/día3, y la Directiva para fórmulas infantiles exige un contenido de hierro en fórmulas de continuación entre 0,6 y 2 mg/100 kcal. Por otro lado, es importante evitar ingestas excesivas de hierro, ya que algunos estudios epidemiológicos realizados en humanos y animales han sugerido que una elevada ingesta (superior a la ingesta de hierro recomendada por edad) puede provocar estrés oxidativo, al quedar en el lumen intestinal un 1%, no absorbido, que parece participar en la generación de radicales libres16,17.
Requerimientos de hierro en niños menores de 12 meses
La ingesta recomendada de hierro debe plantearse teniendo en consideración la biodisponibilidad del mismo en la dieta que ingiere el niño. Por este motivo, es importante conocer las dos formas fundamentales de hierro presentes en la dieta: a) hierro hemo o hierro orgánico, que aparece en alimentos de origen animal y que se estima que contribuye con un 10-15% de la ingesta total de hierro y se absorbe en un 15-40%, y b) hierro no hemo o hierro inorgánico, que se encuentra fundamentalmente en los alimentos de origen vegetal, y cuya capacidad de ser absorbido por el organismo es inferior al 10%22.
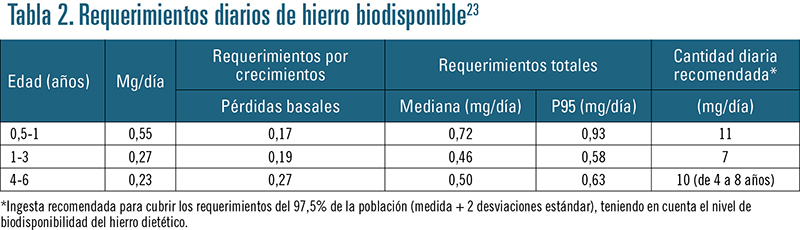 Las recomendaciones se han establecido para dos grupos de edad, de 1-6 meses y de 6-12 meses, en los que, debido a su alta vulnerabilidad a deficiencias nutricionales, resulta especialmente necesaria la presencia de hierro dietético en una forma química altamente biodisponible para asegurar un óptimo estado nutricional de dicho mineral. Las ingestas de hierro recomendadas según el Instituto de Medicina de Estados Unidos son de 11 mg/día para niños de entre 6 meses y 1 año de edad, y de 7 mg/día para niños de 12-36 meses3 (tabla 2).
Las recomendaciones se han establecido para dos grupos de edad, de 1-6 meses y de 6-12 meses, en los que, debido a su alta vulnerabilidad a deficiencias nutricionales, resulta especialmente necesaria la presencia de hierro dietético en una forma química altamente biodisponible para asegurar un óptimo estado nutricional de dicho mineral. Las ingestas de hierro recomendadas según el Instituto de Medicina de Estados Unidos son de 11 mg/día para niños de entre 6 meses y 1 año de edad, y de 7 mg/día para niños de 12-36 meses3 (tabla 2).
En cuanto a las fórmulas infantiles, la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) ha realizado numerosas revisiones de su composición desde los años setenta. El último trabajo publicado a este respecto fue el realizado por un grupo de expertos en 2005, en el que se recomendó un contenido de 0,3-1,3 mg/100 kcal para fórmulas infantiles, sin distinción entre fórmulas de inicio o continuación24. Poco tiempo después, este documento sirvió de base para la redacción de la Directiva europea marco que legislaría la composición de las fórmulas infantiles25. Pocos estudios han evaluado la composición y absorción de hierro de fórmulas y cereales infantiles. García Lorda26, en un estudio realizado en 2002, observó contenidos de 10-12 mg/mL en fórmulas y de 0,76-1,3 mg/100 g en cereales, de los cuales sólo se absorbe un 4% en las fórmulas infantiles y un 5-8% en los cereales infantiles. Esta variabilidad en la absorción de hierro viene determinada no sólo por la cantidad de este mineral en la dieta, sino por la forma en que se encuentra y por la presencia de activadores o inhibidores de su absorción26. No obstante, es necesario tener en cuenta la variabilidad que existe al estimar la absorción de hierro en los niños, en la que influyen la edad, el estatus mineral y los métodos de análisis empleados14.
Durante el periodo de diversificación progresiva de los alimentos se fomenta, en general, el uso de fuentes adicionales de hierro. Las sales empleadas para la fortificación de cereales y fórmulas infantiles son, en general, solubles en agua, con una alta biodisponibilidad. Se recomienda evitar el uso de leches con bajo contenido en hierro, como la leche de vaca, cabra o soja. Igualmente, se recomienda un consumo de leche de 500 mL/día, así como el consumo de alimentos ricos en vitamina C para potenciar la absorción del hierro. Se aconseja también introducir, de un modo progresivo, carnes o pescados en forma de puré a partir de los 6 meses de edad, reforzando el consumo de nutrientes que ayuden a la absorción del hierro, como vitamina C, proteínas de origen animal, polisacáridos, aminoácidos, etc. Asimismo, se recomienda reducir el consumo de alimentos que contienen inhibidores de absorción de hierro o antinutrientes, como fibra, calcio, oxalatos, fitatos y fosfatos, que suponen una disminución en la biodisponibilidad del hierro ingerido22.
 Evaluación de la deficiencia de hierro en niños menores de 12 meses
Evaluación de la deficiencia de hierro en niños menores de 12 meses
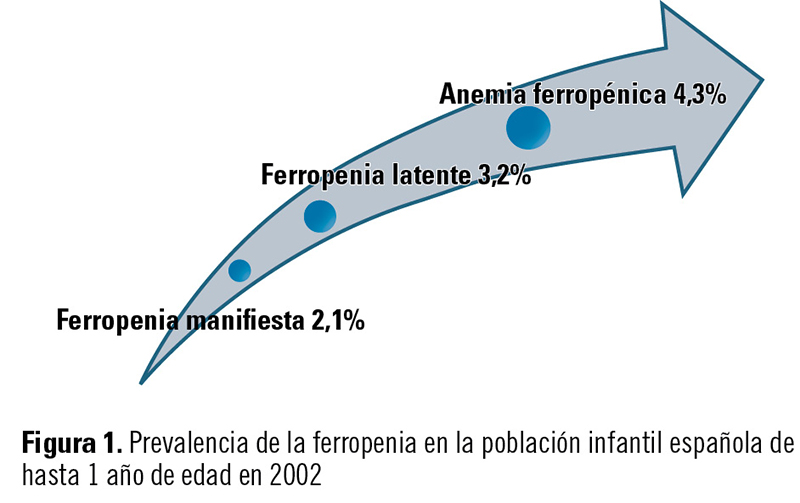
Para conocer la relevancia de la deficiencia de hierro en los menores de 12 meses, debemos evaluar cuáles son los efectos de una deficiencia de hierro en el desarrollo del niño. Atendiendo a los niveles de las reservas biológicas de hierro en el organismo, podemos clasificar la deficiencia de hierro, o ferropenia, del modo siguiente: ferropenia latente (déficit en los depósitos de hierro en el organismo), ferropenia manifiesta (disminución en los niveles de hierro plasmático o circulante) y anemia ferropénica (con afectación de la hematopoyesis)27,28; esta última es la de mayor prevalencia (figura 1)29.
Los efectos de una deficiencia de hierro nutricional en el niño se han relacionado principalmente con un daño en numerosos procesos que suceden en el sistema nervioso central y durante el desarrollo del sistema cognitivo y psicomotor30,31. Si la situación deficitaria en hierro no se corrige rápidamente, la aparición de dichas alteraciones puede tornarse irreversible. Los mecanismos por los que se puede producir un daño sobre el desarrollo cognitivo del niño continúan, hoy día, sin estar completamente dilucidados; los más probables son el daño directo en las células nerviosas y/o los neurotransmisores, o bien un deficitario aporte de oxígeno al cerebro en los casos de anemia. Esta situación afecta a las funciones de memoria, aprendizaje y desarrollo cognitivo del niño. Además, hay estudios que vinculan una situación de déficit de hierro con una maduración inadecuada del sistema inmunitario del niño, en la que se observa una deficiente proliferación en los linfocitos T, mediante mecanismos no completamente conocidos por el momento32, una deficiente diferenciación de macrófagos, una actividad bactericida intracelular y de las células natural killer, y una producción linfocitaria de interleucina 2 y de inmunoglobulinas33.
Prevención de la deficiencia de hierro en la población infantil
La prevención primaria de la deficiencia de hierro tiene relevancia a partir de los 4-7 meses de vida, e implica asegurar una ingesta adecuada de este mineral y favorecer su absorción. Actualmente existen tres estrategias definidas por la Organización Mundial de la Salud34 para abordar las deficiencias de micronutrientes: fortificación de alimentos, suplementación y diversificación de la dieta. De estas estrategias, se sabe que la diversificación de la dieta es el método de preferencia. Los alimentos más aconsejados por su riqueza en hierro son las carnes rojas, las legumbres y los cereales fortificados en hierro, así como las frutas (principalmente por su aporte en vitamina C). No obstante, la alimentación en esta etapa presenta limitaciones importantes y está condicionada por el grado de madurez de los procesos fisiológicos para la asimilación de determinados nutrientes35. Por tanto, es necesario respetar el tiempo de introducción de cada tipo de alimento en la dieta del niño durante este periodo. Sólo en los niños que, durante esta etapa, no ingieren cantidades adecuadas de hierro procedente de los alimentos, y por periodos a corto plazo, la suplementación mineral resulta una intervención efectiva35.
Fortificación de los alimentos
La adición de hierro como suplemento en los alimentos infantiles en una forma químicamente biodisponible y, por tanto, absorbible por el organismo, constituye uno de los mayores retos a los que se enfrenta la industria alimentaria. La fortificación de los alimentos es la solución más práctica, sostenible y económica para el control de la deficiencia en hierro. No obstante, se considera un método que genera ciertas dificultades, fundamentalmente de tipo tecnológico, y que puede resultar más complicado que la fortificación en otros micronutrientes, como el yodo o la vitamina A36-39.
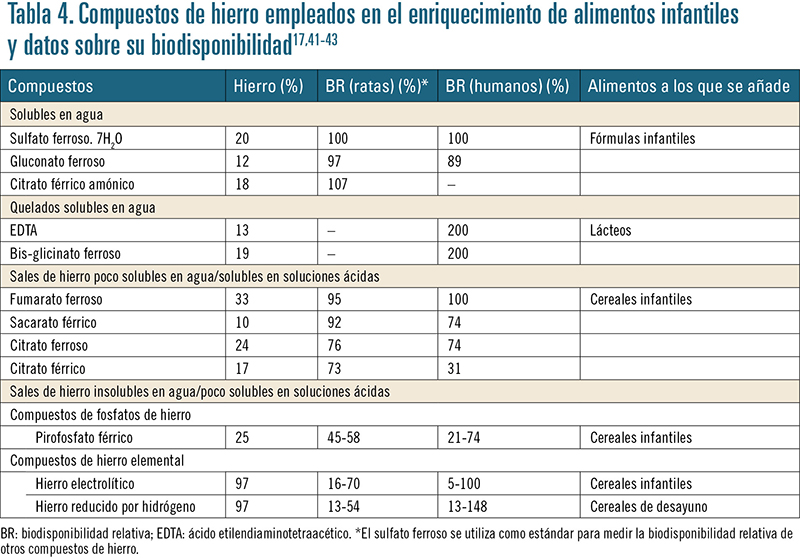
 El éxito de un programa de enriquecimiento depende, en gran medida, de la forma química del hierro añadido, ya que ésta determina su absorción intestinal y su protección frente a inhibidores de su absorción que pueden estar presentes naturalmente en la dieta, así como también del nivel y hábitos de consumo de los alimentos fortificados34. La mayoría de los compuestos de hierro empleados para la fortificación reaccionan con los componentes propios de los alimentos, causando alteraciones nutricionales y organolépticas. Por ello, se eligen para la fortificación formas menos solubles de hierro, hecho que conlleva una menor capacidad de absorción. La fortificación con dosis más bajas de hierro aproxima los valores a los que aparecen de manera fisiológica en los alimentos, considerándose una forma más segura al evitar una posible sobrecarga del organismo con este mineral38-40. Sin embargo, no todas las sales de hierro están autorizadas para fortificar alimentos infantiles. En la tabla 3 se muestran las sales permitidas y en la tabla 4 los datos de biodisponibilidad de las sales de hierro utilizadas en la alimentación infantil en general.
El éxito de un programa de enriquecimiento depende, en gran medida, de la forma química del hierro añadido, ya que ésta determina su absorción intestinal y su protección frente a inhibidores de su absorción que pueden estar presentes naturalmente en la dieta, así como también del nivel y hábitos de consumo de los alimentos fortificados34. La mayoría de los compuestos de hierro empleados para la fortificación reaccionan con los componentes propios de los alimentos, causando alteraciones nutricionales y organolépticas. Por ello, se eligen para la fortificación formas menos solubles de hierro, hecho que conlleva una menor capacidad de absorción. La fortificación con dosis más bajas de hierro aproxima los valores a los que aparecen de manera fisiológica en los alimentos, considerándose una forma más segura al evitar una posible sobrecarga del organismo con este mineral38-40. Sin embargo, no todas las sales de hierro están autorizadas para fortificar alimentos infantiles. En la tabla 3 se muestran las sales permitidas y en la tabla 4 los datos de biodisponibilidad de las sales de hierro utilizadas en la alimentación infantil en general.
 Entre los compuestos de hierro inorgánico más utilizados en la fortificación de alimentos infantiles, podemos considerar tres grupos principales en función de su solubilidad en agua:
Entre los compuestos de hierro inorgánico más utilizados en la fortificación de alimentos infantiles, podemos considerar tres grupos principales en función de su solubilidad en agua:
Solubles en agua
Son los compuestos de hierro más biodisponibles y se emplean principalmente para la elaboración de productos líquidos, como las fórmulas infantiles. No obstante, este tipo de sales puede producir un efecto negativo sobre las propiedades organolépticas del producto (cambios en el color y aparición de sabor metálico, enranciamiento) y la oxidación de grasas. Dentro de este grupo de compuestos, el sulfato ferroso (FeSO4 *7H2O) se utiliza habitualmente como patrón de referencia para medir la biodisponibilidad relativa de otros compuestos de hierro, presentando una biodisponibilidad relativa (BR) del 100%44. Su absorción puede variar entre el 1 y el 50%, según el estado nutricional de hierro del individuo, la presencia de inhibidores y favorecedores de la absorción del hierro en la dieta y el propio contenido de hierro de la dieta44.
Además, el sulfato ferroso puede conllevar un aumento del estreñimiento. Se han observado daños reversibles en el estómago y el duodeno con dosis únicas elevadas en animales de experimentación45. Por ello, es aconsejable el estudio de otras sales de hierro como alternativa para la suplementación. En cualquier caso, antes de su empleo, es necesario tener en cuenta que el gluconato ferroso y el citrato férrico amónico son compuestos que causan problemas organolépticos similares al sulfato ferroso y que tienen un precio más elevado que éste44, lo que finalmente en muchos casos va a condicionar su uso por parte de la industria alimentaria.
Poco solubles en agua/solubles en soluciones ácidas
Estos compuestos se disuelven lentamente en el medio ácido del estómago. Causan muy pocos problemas organolépticos comparados con los compuestos de hierro hidrosolubles, y tienen una biodisponibilidad relativa similar a la del sulfato ferroso46. El fumarato ferroso es el principal compuesto de este grupo y se absorbe en baja concentración en las personas con reducida secreción gástrica, en particular en los niños47. El citrato férrico, cuya biodisponibilidad se estima en un 75%, es otro compuesto que pertenece a este grupo, y en humanos presenta una baja absorción comparada con el hierro elemental. Existen algunas evidencias que indican que el tratamiento tecnológico puede influir en la biodisponibilidad de alguno de estos compuestos de hierro48.
Poco solubles en agua/solubles en soluciones ácidas
Este tipo de compuestos son bastante inertes, con escasos efectos sobre las propiedades sensoriales de los alimentos. Sin embargo, su absorción podría estar comprometida debido a unos niveles muy bajos de solubilidad. Existen tres tipos diferentes de compuestos de hierro insolubles en agua49,50:
1. Compuestos de fosfato de hierro. El pirofosfato férrico (Fe4 [P2O7]3 *H2O) y el ortofosfato férrico (FePO4 *H2O) son escasamente solubles en soluciones ácidas, y su biodisponibilidad relativa es muy variable, de un 15-75% y un 6-46%, respectivamente49. La solubilidad de estos compuestos depende, entre otros factores, de sus características físicas, tamaño, forma y área de superficie de las partículas.
2. Compuestos de hierro elemental. Son, en general, los más utilizados en el enriquecimiento de cereales infantiles, entre los cuales el hierro electrolítico es el único polvo de hierro elemental actualmente recomendado para el enriquecimiento de los cereales49. La biodisponibilidad relativa del hierro electrolítico, comparada con la del sulfato ferroso, se estima en un 75%, mientras que la del hierro elemental reducido por hidrógeno varía entre el 13 y el 148% en humanos. En este sentido, hay estudios que demuestran que una alternativa para mejorar la biodisponibilidad relativa del hierro elemental puede ser la adición del ácido ascórbico49.
3. Compuestos de hierro protegidos. Dentro de éstos, los compuestos quelados y los compuestos encapsulados son los que presentan un mayor interés:
• Compuestos quelados de hierro. El más comúnmente utilizado es el etilendiaminotetraacetato ferrosódico (NaFeEDTA). La ventaja principal del uso del NaFeEDTA en la fortificación de alimentos es que, en esta forma, el hierro está protegido de los inhibidores de absorción del hierro de los alimentos en el estómago. Si la dieta presenta bajos niveles de inhibidores de la absorción, el efecto estimulante del Na2EDTA tiene poca importancia; por el contrario, si el régimen alimentario es rico en inhibidores de la absorción, el Na2EDTA incrementa considerablemente su disponibilidad. La adición de Na2EDTA, alcanzando un cociente molar de EDTA/hierro entre 0,5:1 y 1:1, puede mejorar la absorción del hierro de los alimentos enriquecidos con sulfato ferroso51. El NaFeEDTA fue aprobado en 1999 por el Comité Mixto FAO/OPS52 de Expertos en Aditivos Alimentarios para ser utilizado en programas supervisados en zonas con una alta prevalencia de carencia de hierro, en una ingesta máxima de este mineral de 0,2 mg/kg de peso corporal por día. Su eficacia como quelante depende de la constante de estabilidad entre el EDTA y el hierro a un valor de pH determinado. Se ha observado que el uso del NaFeEDTA para enriquecer los alimentos tiene ciertas ventajas. Por ejemplo, en presencia de ácido fítico, un típico inhibidor de la absorción del hierro presente en los cereales infantiles, duplica e incluso triplica su absorción frente al sulfato ferroso50. Además, este tipo de compuesto no favorece la oxidación de los lípidos durante el almacenamiento de las harinas de cereales, aunque sí se han observado ciertas modificaciones organolépticas no deseadas53,54, como reacciones de color no buscadas similares a las producidas por el sulfato ferroso, y que podrían conllevar un rechazo por parte del consumidor. Otro inconveniente es el elevado coste del NaFeEDTA (6 veces más que el sulfato ferroso). Otro compuesto quelado es el bisglicinato ferroso (hierro aminoquelado), que también tiene ventajas parecidas, ya que puede proteger al hierro de los inhibidores dietéticos de su absorción, como el ácido fítico55 presente en los cereales. Sin embargo, tiene un elevado potencial de óxido-reducción y, por consiguiente, una elevada tendencia a causar procesos de oxidación lipídica y reacciones no deseadas sobre el color y la oxidación de grasas (rancidez). También su coste es superior al del sulfato ferroso, un inconveniente importante en un producto como los cereales infantiles, cuyo papel en la dieta es complementario y no principal, como las fórmulas infantiles. No obstante, debido a su elevada biodisponibilidad56, se debe contemplar la posibilidad de emplear pequeñas cantidades para compensar su mayor coste.
• Compuestos encapsulados. Dentro del grupo de los compuestos de hierro protegido, se incluyen el sulfato ferroso, el fumarato ferroso, el pirofosfato férrico y el hierro elemental encapsulado. Estos compuestos de hierro se utilizan en el enriquecimiento de fórmulas infantiles y cereales, y en ellos la sal de hierro está cubierta con capas de aceite hidrogenado, etilcelulosa o maltodextrina, las cuales impiden que los átomos de hierro entren en contacto con otras sustancias en la matriz alimentaria hasta que puedan ser liberados y absorbidos en el intestino delgado. Una de las ventajas que presentan es la ausencia o retraso en la aparición de cambios sensoriales debidos a los procesos de oxidación de los ácidos grasos, de aminoácidos y de otros micronutrientes. Además, pueden reducir las interacciones con los inhibidores de la absorción del hierro presentes en la dieta (ácido fítico, taninos y polifenoles). El material de la cápsula, la proporción entre el material de la cápsula y el contenido en hierro, y el proceso industrial empleado en la encapsulación son algunos de los factores que pueden influir en la biodisponibilidad del hierro procedente de esta fuente53. Además, en general, las cápsulas tienen un bajo punto de fusión (45-65 °C), por lo que, si son destruidas durante la preparación del alimento, pueden aparecer cambios sensoriales no deseados en éste. Recientes investigaciones han demostrado que la micronización (proceso que implica un aumento de la superficie del sólido) de los compuestos insolubles en agua puede mejorar la biodisponibilidad de los mismos, como en el caso del pirofosfato férrico micronizado, en el que se enmascara el gusto y el olor desagradable del mineral, además de presentar una importante característica frente a los compuestos de hierro solubles (como el sulfato ferroso): no provoca irritación en el sistema gastrointestinal57.
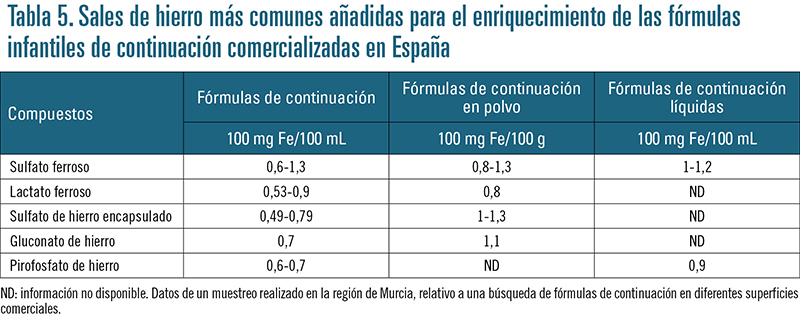 En la tabla 5 se recogen las formas de hierro empleadas en los preparados infantiles fortificados (fórmulas y cereales infantiles) de mayor consumo en España.
En la tabla 5 se recogen las formas de hierro empleadas en los preparados infantiles fortificados (fórmulas y cereales infantiles) de mayor consumo en España.
Estrategias para aumentar la absorción de hierro
Las estrategias más frecuentes empleadas para reducir la incidencia de desnutrición por déficit mineral son el empleo de suplementos farmacéuticos, la fortificación de los alimentos, una dieta más variada y el uso de procesos tecnológicos que permitan eliminar o degradar inhibidores de la absorción de hierro y la adición de promotores de la absorción55-58. Por distintos motivos, ninguno de ellos ha resultado del todo eficaz.
El hierro, en sus formas más absorbibles, es un elemento altamente reactivo que puede afectar negativamente a las propiedades sensoriales de los alimentos fortificados. La compatibilidad tecnológica con el vehículo alimentario es, por consiguiente, un factor importante. Una estrategia interesante sería incrementar el nivel total de micronutrientes de los alimentos de origen vegetal, al tiempo que se incrementa la concentración de componentes que favorezcan su absorción y/o se disminuye el contenido en componentes que inhiben su absorción, mediante el empleo de variedades de la planta o el uso de la ingeniería genética59. En la industria alimentaria se han desarrollado estrategias encaminadas a mejorar la absorción de hierro presente en los alimentos infantiles. Así, el empleo de ciertos componentes favorecedores en la elaboración de estos productos, como algunos ácidos orgánicos, y más concretamente el ácido ascórbico, va a suponer en general una mejora en la absorción del hierro, tanto en fórmulas infantiles como en cereales infantiles. En cantidades relativamente altas (a una razón molar ≥2:1, ácido ascórbico a hierro, o una razón de peso de 6:1), el ácido ascórbico puede aumentar la absorción de hierro 2-3 veces60,61. Sin embargo, el ácido ascórbico no es estable cuando se expone al aire y el calor, lo que significa que se requiere un envasado costoso para preservarlo. El encapsulamiento podría resultar útil. En otros estudios, se ha observado que la adición de vitaminas del grupo B, en concreto el ácido fólico, la vitamina B6 y la vitamina B12, favorece la absorción del hierro57.
Por otro lado, también se ha estudiado la reducción de inhibidores de la absorción. El ácido fítico, presente habitualmente en los cereales, puede suponer una merma en la biodisponibilidad del hierro. Con una mejora en los tratamientos tecnológicos a los que son sometidos los cereales podría reducirse la acción del ácido fítico sobre el hierro62. La desfitinización, o eliminación del ácido fítico, se ha estudiado como una estrategia particularmente útil para mejorar la absorción del hierro de los cereales y los alimentos complementarios. Sin embargo, debe extraerse prácticamente todo el fitato para obtener un aumento importante de la absorción de hierro63.
Por tanto, para el correcto establecimiento de un programa de fortificación en hierro de alimentos infantiles, se debe tener en cuenta una serie de factores, como los siguientes:
• Empleo de un vehículo alimentario específico, en el periodo sensible de alimentación complementaria.
• Aporte del compuesto que proporcione una mayor cantidad disponible de hierro para cubrir las necesidades del niño, que no cause cambios sensoriales y que tenga un coste bajo.
• Aplicación de determinados procesos tecnológicos sobre la matriz del alimento para reducir los inhibidores de la absorción, y que mejoran la absorción intestinal del hierro presente.
La eficacia de la fortificación con hierro en alimentos infantiles está ampliamente estudiada y contrastada. Sin embargo, hay pocos datos sobre la biodisponibilidad y absorción de estas fuentes en humanos, y aún menos en niños. Por su parte, la fortificación de cereales y fórmulas infantiles presenta ciertas dificultades, fundamentalmente a la hora de conseguir fuentes de hierro que reúnan una buena biodisponibilidad y comportamiento tecnológico al mismo tiempo. Las necesidades que se plantean en niños desde los 6 meses a los 3 años de edad, tanto en los países desarrollados como en los no desarrollados, exigen un estudio conjunto de la industria alimentaria, de los centros de investigación y médicos para mejorar el diseño de los alimentos infantiles, que se profundice en el estudio de la biodisponibilidad y se evalúe la eficacia clínica de las medidas adoptadas.
Bibliografía
1. Ministerio de Sanidad de España. Porcentaje de niños menores de 5 años alimentados total o parcialmente con lactancia materna. Informe 2007. Madrid: Ministerio de Sanidad, 2007.
2. Dietary reference intakes (DRI). Institute of Medicine (US) Committee to review recommended intakes for individuals. Food and Nutrition Board. Washington, DC: The National Academies Press, 2010.
3. Dalmau J. Nutrición en la infancia y adolescencia. En: Carbajal A, Martínez M, eds. Manual práctico de nutrición y salud. Madrid: Exlibris ED, 2012; 207-221.
4. ESPGHAN Committee on Nutrition, Agostoni C, Braegger C, Decsi T, Kolacek S, Koletzko B, et al. Breast-feeding: A commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2009; 49(1): 112-125.
5. Indicators infant and young child feeding practices: conclusions of a consensus meeting held in Washington DC 2007, 6-8 November. Washington DC: WHO, 2007.
6. American Academy of Pediatrics, Section on Breastfeeding. Breastfeeding and the use of human milk. Pediatrics. 2012; 129: e827-e841.
7. Hernández AM, Aguayo MJ. Breastfeeding. How to promote and support breastfeeding in pediatric practice. Recommendations of the Breastfeeding Committee. An Pediatr (Barc). 2005; 63: 340-356.
8. International Lactation Consultant Association. Clinical guidelines for the establishment of exclusive breastfeeding. ILCA, USA, 2005.
9. EU Project on Promotion of Breastfeeding in Europe. Protection, promotion and support of breastfeeding in Europe: a blueprint for action. Luxemburgo: European Commission, Directorate Public Health and Risk Assessment, 2004.
10. León-Cava N, Lutter C, Ross J, Martin L. Quantifying the benefits of breastfeeding: a summary of the evidence. Washington DC: Pan American Health Organization, 2002.
11. Zimmermann MB, Hurrell RF. Nutritional iron deficiency. Lancet. 2007; 370: 511-520.
12. Scholl To. Iron status during pregnancy: setting the stage for mother and infants. Am J Clin Nutr. 2005; 15: 225-241.
13. Baker RD, Greer FR; Committee on Nutrition American Academy of Pediatrics. Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0-3 years of age). Pediatrics. 2010; 126: 1.040-1.050.
14. Chaparro C. Setting the stage for child health and development: prevention of iron deficiency in early infancy. J Nutr. 2008; 138: 2.929-2.933.
15. Frontela Saseta C, Martínez Gracia C, Ros Berruezo G. Efectos de la adición de fitasa sobre la biodisponibilidad mineral in vitro en papillas infantiles. PhD Universidad de Murcia, 2007.
16. Freddy JT, Win HMS, Guido, RMM, et al. New method to study oxidative damage and antioxidants in the human small bowel: effects of iron application. Am J Physiol Gastrointest. 2003; 285: 354G-359G.
17. Swain JH, Newman SM, Hunt JR. Bioavailability of elemental iron powders to rats is less than bakerygrade ferrous sulfate and predicted by iron solubility and particle surface area. J Nutr. 2003; 133: 3.546-3.552.
18. Durá Travé T, Díaz Vélaz L. Prevalencia de la deficiencia de hierro en lactantes sanos de 12 meses de edad. An Esp Pediatr. 2002; 57: 209-214.
19. Davidsson L, Kastenmayer P, Yuen M, Lönnerdal B, Hurrell RF. Influence of lactoferrin on iron absorption from human milk in infants. Pediatr Res. 1994; 35(1): 117-124.
20. Sánchez Ruiz-Cabello FJ. Prevención y detección de la ferropenia. En: Recomendaciones PrevInfad/PAPPS. Actualizado en febrero de 2003.
21. American Academy of Pediatrics. Committee on Nutrition. Policy Statement. Iron fortification of infant formulas. Pediatrics.1999; 104: 119-123.
22. Hurrell R, Egli I. Iron bioavailability and dietary reference values. American Society for Nutrition. Am J Clin Nutr. 2010; 91 Supl: 1.461-1.467.
23. Moráis López A, Dalmau Serra J; Comité de Nutrición de la AEP. Importancia de la ferropenia en el niño pequeño: repercusiones y prevención. España And Pediatr (Barc). 2011; 74(6): 415.e1-415.e10.
24. Koletzko B, Baker S, Cleghorn G, Neto UF, Gopalan S, Hernell O, et al. Global standard for the composition of infant formula: recommendations of an ESPGHAN coordinated international expert group. J Pediatr Gastroenterol Nutr. 2005; 41: 584-599.
25. Directiva 2006/125/CE de la Comisión de 5 de diciembre de 2006 relativa a los alimentos elaborados a base de cereales y alimentos infantiles para lactantes y niños de corta edad.
26. García Lorda P. Dieta controlada en hierro. En: Salas-Salvado J, Bonada A, Trallero R, Saló ME, eds. Nutrición y dietética clínica. Barcelona: Masson, 2002; 382.
27. Yip R, Johnson C, Dallman PR. Age-related changes in laboratory values used in the diagnosis of anaemia and iron deficiency. Am J Clin Nutr. 1984; 39: 427-436.
28. Mateos ME, De la Cruz J, López-Laso E, Valdés MD, Nogales A. Reticulocyte hemoglobin content for the diagnosis of iron deficiency. J Pediatr Hematol Oncol. 2008; 30: 539-542.
29. Monteagudo Montesinos E, Ferrer Lorente B. Deficiencia de hierro en la infancia (I). Concepto, prevalencia y fisiología del metabolismo férrico. Acta Pediatr Esp. 2010; 68(5): 245-251.
30. Shafir T, Angulo-Barroso R, Jing Y, Angelilli ML, Jacobson SW, Lozoff B. Iron deficiency and infant motor development. Early Human Develop. 2008; 84(7): 479-485.
31. Hermoso M, Vucic V, Vollhardt C, Arsic A, Román-Viñas B, Iglesia-Altaba I, et al. The effect of iron on cognitive development and function in infants, children and adolescents: a systematic review. Ann Nutr Metab. 2011; 59(2-4): 154-165.
32. Sejas E, Kolsteren P, Hoeree T, Roberfroid D. Iron supplementation in previously anemia Bolivian children mormalized hematologic parameters, but not immunologic parameters. J Trop Pediatr. 2008; 54(3): 164-168.
33. Oppenheimer SJ. Iron and its relation to immunity and infectious disease. J Nutr. 2001; 131: 616-635.
34. OMS. Worldwide prevalence of anemia. En: Benoist B, McLean E, Egli I, Cogswell M, eds. WHO Global Database on Anemia. Anemia as a public health problem by country: preschool-age children. Ginebra: World Health Organization, 1993-2005; 1-6.
35. Lynch SR. The impact of iron fortification on nutritional anemia. Best Pract Res Clin Hematol. 2005; 18(2): 3.333-3.346.
36. Hurrell RF. How to ensure adequate iron absorption from iron-fortified food. Nutr Rev. 2002; 60: 7S-15S.
37. Baltussen R, Knai C, Sharan M. Iron fortification and iron supplementation are cost-effective interventions to reduce iron deficiency in four subregions of the world. J Nutr. 2004; 134: 2.678-2.684.
38. WHO and FAO. En: Allen L, De Benoist B, Dary O, Hurrell R, eds. Guidelines on food fortification with micronutrients. Ginebra: World Health Organization, 2006; 220-222.
39. Laxminarayan R, Mills AJ, Breman JG, et al. Advancement of global health: key messages from the disease control priorities project. Lancet. 2006; 367: 1.193-1.208.
40. WHO Statement. Iron supplementation of young children in regions where malaria transmission is intense and infectious disease highly prevalent, 2007. Disponible en: http://www.who.int/child-adolescenthealth/New_Publications/Child_Health/WHO_statement_ ron.pdf
41. Hurrell R. Iron. En: Hurrell R, ed. The mineral fortification of foods. Leatherhead, Surrey: Leatherhead International Ltd., 1999; 54-93.
42. Hurrell R, Bothwell T, Cook JD, et al. The usefulness of elemental iron for cereal flour fortification: a sustain task force report. Sharing United States technology to aid in the improvement of nutrition. Nutr Rev. 2002; 60: 391-406.
43. Hurrell R, Lynch S, Bothwell T, et al. Enhancing the absorption of fortification iron. A sustain task force report. Int J Vitam Nutr Res. 2004; 74: 387-401.
44. Hurrell RF. Fortification: overcoming technical and practical barriers. J Nutr. 2002; 132: 806S-812S.
45. Benoni G, Cuzzolin L, Zambreri D, et al. Gastrointestinal effects of single and repeated doses of ferrous sulphate in rats. Pharmacol Res. 1993; 27: 73-80.
46. Davidsson L, Sarker SA, Funchs GJ, Walczyk T, Hurrell RF. Helicobacter pylori infection and iron absorption in Bangladeshi children. Bioavailability of micronutrient in relation topublic health. Interlaken, Suzie, 30 mayo-1 junio de 2001.
47. Hurrell RF, Reddy MB, Dassenko SA, Cook JD, Shepherd D. Ferrous fumarate fortification of a chocolate drink powder. Br J Nutr. 1991; 65: 271-283.
48. Hurrell RF. How to ensure adequate iron absorption from iron-fortified food. Nutr Rev. 2002; 60: 7S-15S.
49. Hurrell RF, Bothwell T, Cook JD, Dary O, Davidsson L, Fairweather-Tait S, et al. The usefulness of elemental iron for cereal flour fortification: a sustain task force report. Nutr Rev. 2002; 60:
391-406.
50. Hurrell RF, Furniss DE, Burri J, Whittaker P, Lynch SR, Cook JD. Iron fortification of infant cereals: a proposal for the use of ferrous fumarate or ferrous succinate. Am J Clin Nutr. 1989; 49: 1.274-1.282.
51. Organización Panamericana de la Salud (OPS). Compuestos de hierro para la fortificación de alimentos. Guía para America Latina y el Caribe. Washington DC: OPS, 2002.
52. Directiva 2006/52/CE de 5 julio NaFeEDTA aprobado en 1999 por el Comité Mixto FAO/OPS.
53. Hurrell RF. Preventing iron deficiency through food fortification. Nutr Rev. 1997b; 55(6): 210-222.
54. Zimmermann MB, Winichagoon P, Gowachirapant S, Hess SY, Harrington M, Chavasit V, et al. Comparison of efficacy of wheat-based snacks fortified with ferrous sulfate, electrolytic iron, or hydrogen-reduced elemental iron: randomized, double-blind, controlled trial in Thai women. Am J Clin Nutr. 2005; 82: 1.276-1.282.
55. Hurrell RF, Reddy MB, Burri J, Cook JD. An evaluation of EDTA compounds for iron fortification of cereal-based foods. Br J Nutr. 2000; 84: 903-910.
56. Bovell-Benjamin AC, Viteri FE, Allen LH. Iron absorption from ferrous bisglycinate and ferric trisglycinate in whole maize is regulate by iron status. Am J Clin Nutr. 2000; 71: 1.563-1.569.
57. Haro Vicente JF, Pérez Conesa D, Rincón León F, Ros G, Martínez Gracia MC, Vidal Guevara ML. Does ascorbic acid supplementation affect iron bioavailability in rats fed micronized dispersible ferric pyrophosphate fortified fruit juice? Eur J Nutr. 2008; 48: 415-423.
58. Maberly GF, Trowbridge FL, Yip R, Sullivan KM, West CE. Programs against micronutrient malnutrition: ending hidden hunger. Ann Rev Public Health. 1994; 277-301.
59. Greiner R, Konietzny U. Phytase for food application. Food Technol Biotechnol. 2006; 44(2): 125-140.
60. Derman DP, Bothwell TH, MacPhail AP, Torrance JD, Bezwoda WR, Charlton RW, et al. Importance of ascorbic acid in the absorption of iron from infant foods. Scand J Haematol. 1980; 25: 193-201.
61. Stekel A, Olivares M, Pizarro F, Chadud P, López I, Amar M. Absorption of iron from milk formulas in infants. Am J Clin Nutr. 1986; 43: 917-922.
62. Hurrell F, Lynch S, Bothwell T, Corei H, Glahn R, Hertrampf E, et al. Enhancing the absorption of fortification iron. Int J Vitam Nutr Res. 2004; 74(6): 387-401.
63. Frontela C, Scarino ML, Ferruzza S, Ros G, Martínez C. Effect of dephytinization on bioavailability of iron, calcium and zinc from infant cereals assessed in the Caco-2 cell model. World J Gastroenterol. 2009; 15(16): 1.977-1.984.
| *Artículo publicado en Acta Pediátrica Española 2015; 73(10): 269-276. |
