La enfermedad de Alzheimer (EA) y la enfermedad de Parkinson (EP) conforman un grupo heterogéneo de trastornos caracterizados por una pérdida progresiva y selectiva de los sistemas neuronales (anatómica o fisiológicamente), que suelen incluirse en el concepto amplio de «demencias».
Si bien la mayoría de estas enfermedades afectan a pacientes de edad avanzada, hay evidencias que sugieren la existencia de una etapa «preclínica». En esta fase, el diagnóstico es de vital importancia para poder aplicar las medidas preventivas odontológicas necesarias. Si no se aplican estas medidas, la salud bucodental de los pacientes, en términos de caries, enfermedad periodontal o de las encías, y del cuidado de las prótesis dentales, empeorará con la progresión de la enfermedad.
Un diagnóstico precoz puede contribuir a la mejor gestión de la atención al paciente, y por este motivo es necesario disponer de biomarcadores que puedan ayudar tanto a realizar este diagnóstico como a controlar la progresión y la respuesta al tratamiento de estas enfermedades. Los biomarcadores de la saliva pueden contribuir a ello.
Actualmente, para muchas de estas enfermedades neurodegenerativas no existe aún un tratamiento curativo, pero sí disponemos de tratamientos sintomáticos, y están surgiendo nuevos fármacos para prevenir y/o revertir la aparición y/o el progreso de estos trastornos. Como veremos seguidamente, también existen unos protocolos para la prevención y el manejo odontológico del paciente con deterioro cognitivo.
Salud oral de los pacientes con deterioro cognitivo
La demencia se caracteriza por déficits cognitivos múltiples que implican un deterioro de la memoria, lo que conlleva diferentes problemas de salud. Los pacientes que sufren este tipo de trastornos cognitivos suelen olvidarse de tomar la medicación (incumplimiento terapéutico), tienen dificultades para llevar a cabo una higiene diaria satisfactoria (autocuidado insuficiente), y no utilizan adecuadamente los servicios dentales, con la consecuente aparición de enfermedades bucodentales.
Este deterioro de las capacidades cognitivas y de las actividades de la vida diaria en los pacientes con algún tipo de demencia tiene, por tanto, implicaciones en su salud bucodental. Distintos estudios confirman esta asociación entre el deterioro cognitivo y una pobre salud oral: dificultades en la higiene de la prótesis, caries dental, problemas en las encías, ausencia de dientes, pobre estabilidad, falta de uso de las dentaduras, etc. Todo ello repercute en la aparición de otros problemas, como disminución de la calidad de vida, deficiente estado nutricional y enfermedades sistémicas (p. ej., neumonía por aspiración).
Un reciente estudio turco que evaluó la salud oral de pacientes con EA comparándolos con un grupo control de voluntarios sanos pudo constatar que, en el grupo EA, los pacientes olvidaban retirarse las prótesis completas por la noche (diferencia estadísticamente significativa). Asimismo, se observó que el cepillado de los dientes y el cuidado de las prótesis eran más irregulares en este grupo, y que también eran más frecuentes las lesiones de la mucosa oral (candidiasis o úlceras de decúbito) relacionadas con el empleo de prótesis removibles.
La hipótesis de que las personas con una mala salud bucodental podrían tener un mayor riesgo de desarrollar demencia llevó a un grupo de investigadores franceses a realizar un estudio de cohortes con personas mayores de 65 años (405 pacientes). El objetivo era valorar su salud bucodental y evaluar la posible relación con la aparición de demencia. Las variables bucodentales estudiadas fueron «número de dientes», «ausencia de piezas dentales», «dientes obturados» y «dientes cariados», «presencia de prótesis», «patología de la articulación temporomandibular», «número de cálculos y bolsas periodontales» y «número de pares de dientes en oclusión posterior»; además, se aplicó el «Índice Periodontal Comunitario», el «índice de sangrado», y un cuestionario sobre la frecuencia de visitas al dentista, hábitos de higiene oral, dolor y disconfort oral, y necesidades de tratamiento referidas por los propios entrevistados.
Junto a estas variables se analizaron también variables sociodemográficas y sobre la demencia, para llevar a cabo un análisis univariado y multivariado. El estudio concluyó que los casos con once o más dientes perdidos parecían estar asociados a un menor riesgo de demencia en aquellos pacientes con un menor nivel educativo, posiblemente debido a la supresión de la fuente de la inflamación crónica, como es la enfermedad de las encías.
En sentido opuesto, la hipótesis de que las personas mayores con demencia tienen mayor riesgo de padecer enfermedades bucodentales también ha sido motivo de estudio. Un estudio transversal realizado en Finlandia concluyó que los pacientes con EA o cualquier otro deterioro cognitivo (no parece influir el tipo de demencia) tienen un mayor riesgo de presentar una pobre salud bucodental, y una pobre higiene oral y de las prótesis en comparación con los pacientes sin demencia.
Asimismo, un estudio brasileño en el que se realizaron encuestas a pacientes diagnosticados de EA y a sus cuidadores concluyó que las personas con EA presentan un deterioro significativo de su salud bucodental, pero sin poder constatar ninguna asociación entre la gravedad de su enfermedad y la presencia de problemas bucodentales.
Es importante que el plan de cuidados en la salud bucodental de estos pacientes se realice en consenso con sus cuidadores, puesto que van a tener un papel fundamental en el progreso de su enfermedad: el número de dientes y la salud bucodental del paciente van a depender de la eficacia de la higiene oral realizada a diario.
Un estudio danés constató que las caries radiculares (raíces de los dientes) también tenían una elevada prevalencia en los pacientes daneses diagnosticados recientemente de EA, sobre todo en aquellos con una elevada prevalencia de caries en la corona del diente. Además, los pacientes mayores de 81 años que presentan múltiples obturaciones en las raíces de los dientes tienen más probabilidad de padecer numerosas lesiones en la raíz de caries no tratadas.
Con respecto a la salud bucodental de los pacientes con deterioro cognitivo residentes en instituciones especiales, los resultados de distintos estudios demuestran que su higiene bucal es pobre y que tienen menos flujo salival y una mayor incidencia de caries con respecto a los pacientes sin demencia. Además, también se ha constatado que estos problemas bucodentales son más pronunciados en los estadios severos de la enfermedad.
Existen asimismo diferencias en el estado nutricional entre los pacientes con EA que viven en instituciones y los que viven en su propio domicilio. La elección de la consistencia de las comidas se correlaciona con la salud bucodental, pero el estado nutricional no parece verse influenciado por la condición dental del paciente. Sin embargo, la habilidad de comer sin ayuda parece estar fuertemente correlacionada con el estado cognitivo.
Detección precoz del deterioro cognitivo
El diagnóstico precoz de la EA podría permitir el uso temprano de fármacos, como los inhibidores de la acetilcolinesterasa. También ofrece otros beneficios para los pacientes y los cuidadores, incluyendo la evaluación y el tratamiento de algunas enfermedades concomitantes, como la depresión.
Los cambios neuropatológicos propios de la EA se caracterizan sobre todo por la agregación anormal de proteínas, en concreto, la proteína tau hiperfosforilada intraneuronal en forma de ovillos neurofibrilares, y la beta-amiloide extraneuronal en forma de placas seniles. De forma gradual, estos cambios conllevan una pérdida de sinapsis y neuronas que se manifiesta clínicamente como alteraciones cognitivas.
Hoy en día, aunque se ha avanzado mucho, el diagnóstico de la EA sigue siendo tanto clínico como por exclusión de cualquier otra causa de demencia, y su diagnóstico definitivo se sigue haciendo post mórtem. En la actualidad, no se dispone todavía de ninguna prueba o marcador que sea exclusivo para la EA.
Sin embargo, distintos estudios han demostrado la eficacia de tratar la EA en fases muy iniciales, por lo que su detección se ha convertido en uno de los principales focos de investigación en el campo de las enfermedades neurodegenerativas. A la luz de estos hechos, sería particularmente útil hallar un biomarcador molecular para poder identificar y clasificar la EA con el fin de confirmar el tratamiento.
El biomarcador ideal para detectar la EA debe ser lo más sensible y específico posible, fiable y reproducible, simple de realizar, de bajo coste y no invasivo, como son los análisis de sangre, de orina o de saliva.
La mayoría de los estudios aceptados sobre biomarcadores de la EA se han llevado a cabo analizando muestras de fluido cerebroespinal a través de punciones lumbares, pero este tipo de prueba, muy invasiva, no resulta muy conveniente para la práctica clínica diaria.
Diferentes estudios han demostrado que la identificación de biomarcadores sanguíneos permitirá el desarrollo de pruebas para la detección de la EA.
Un grupo de investigadores del Centro Médico de la Universidad de Georgetown (Estados Unidos) han validado un análisis de sangre que puede predecir con más de un 90% de exactitud si una persona sana va a desarrollar deterioro cognitivo leve o EA en 3 años. Esta investigación anuncia por tanto la posibilidad de desarrollar estrategias de tratamiento para la EA en una etapa precoz de la enfermedad, cuando serían más eficaces para retardar o prevenir la aparición de los síntomas, mediante biomarcadores sanguíneos de Alzheimer preclínico. Este reciente estudio revela la importancia de los biomarcadores sanguíneos en la detección temprana del deterioro cognitivo. En este trabajo, se analizaron los niveles de metabolitos lipídicos en plasma sanguíneo de 525 personas de más de 70 años. Se identificaron 10 lípidos que permitían distinguir, con un 90% de precisión, entre las personas que desarrollarían deterioro cognitivo y las que no. El estudio recoge el seguimiento a 5 años de los participantes, a los que, además de extracciones sanguíneas anuales, realizaron pruebas de habilidades cognitivas y de memoria. Mediante espectrometría de masas, los investigadores analizaron el perfil lipídico en plasma, encontrándose niveles bajos de 10 fosfolípidos que estaban presentes en la sangre de la mayoría de los pacientes que tenían, o iban a desarrollar, deterioro cognitivo.
Aunque los investigadores desconocen el origen de estos fosfolípidos, se trata de biomoléculas naturalmente presentes en las membranas celulares. Por ello, propusieron que las concentraciones de los fosfolípidos podrían reflejar de algún modo la ruptura de las membranas de las células neuronales. La confirmación de estos resultados permitiría avanzar más rápidamente en la investigación de esta enfermedad, ya que la obtención de la muestra es muy fácil (una simple extracción sanguínea). Además, sería posible su uso a gran escala.
En los seres humanos, además de la clásica acumulación en el cerebro de la proteína beta-amiloide, también pueden encontrarse depósitos en las regiones periféricas, incluyendo la piel, la mucosa nasal, el lagrimal y las glándulas salivales.
El uso de biopsias de las glándulas salivales humanas se ha descrito recientemente como una herramienta para la investigación de la EA, ya que la proteína beta-amiloide se encuentra en las células epiteliales salivales de los humanos. La saliva se produce a partir de las glándulas salivales, y es un fluido biológico fácil de obtener. Los niveles salivales pueden reflejar cambios en el líquido cerebroespinal. En un estudio realizado en el Reino Unido, se demostró una asociación entre la EA y los niveles y la actividad de la acetilcolinesterasa en la saliva. Estos hallazgos pueden llegar a ser un marcador útil de la actividad colinérgica, ya que es un factor clave en la bioquímica de la EA.
En un estudio realizado en España, donde se analizaron muestras de saliva de pacientes con EA, personas sanas y pacientes con Parkinson, pudo constatarse que la concentración de beta-amiloide-42 difiere entre los pacientes con EA y los sujetos sanos, por lo que los investigadores concluyen que ésta es una característica específica de la EA (que no se observa en la enfermedad de Parkinson), y que los análisis de saliva de beta-amiloide-42 son poderosos marcadores de riesgo para el desarrollo de EA.
La glándula submandibular es la que produce la mayor parte del flujo salival, tanto en reposo como estimulada, y se ve afectada de forma significativa en los pacientes con EA. En un estudio estadounidense, se identificó en muestras de saliva humana la presencia de proteína tau, que está relacionada con la patogénesis de la EA. Además, se constató que la proteína total tau y la proteína fosforilada tau fue significativamente diferente entre pacientes con EA y los controles.
Prevención de enfermedades bucodentales en pacientes con deterioro cognitivo
Algunos estudios epidemiológicos han demostrado que existe mayor prevalencia de enfermedades bucodentales en pacientes con deterioro cognitivo. Esta mayor frecuencia es evidente tanto en pacientes mayores con demencia que viven en sus domicilios como en aquellos que viven en residencias.
La investigación indica que las estrategias preventivas utilizadas en la población general pueden ser también válidas para la prevención de trastornos bucodentales en pacientes con demencia.
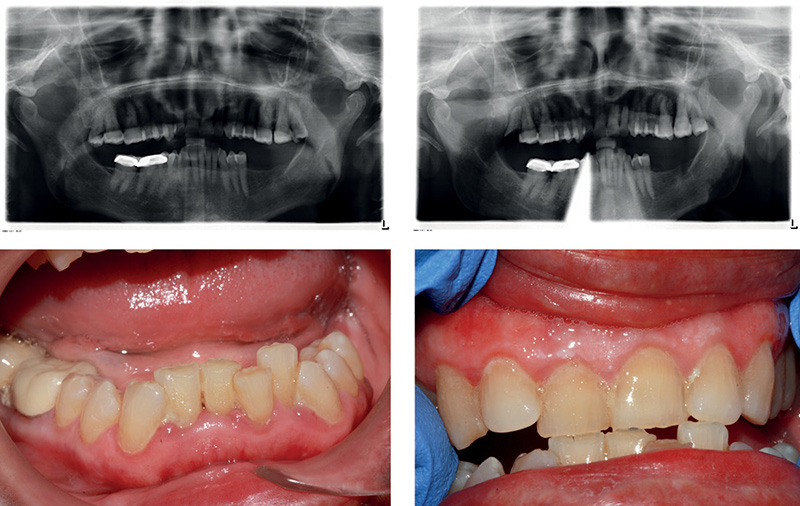
El plan de tratamiento de un paciente con EA debe ser diseñado en función de la severidad de la enfermedad, y siempre en consenso con los miembros de la familia o las personas que se encargan del cuidado del paciente. Debe señalarse que, a medida que avanza la enfermedad, la condición bucodental del paciente empeora progresivamente, sobre todo en lo referente a la higiene bucal, por lo que, si se atiende a un paciente en las primeras etapas de la enfermedad, hay que anticiparse a ese deterioro con medidas urgentes de prevención (aplicaciones tópicas de fluoruros, enjuagues de clorhexidina, etc.) y citas frecuentes para realizar una limpieza dental o profilaxis.
En las etapas iniciales de la EA, el paciente puede empezar a olvidar las citas y las instrucciones postoperatorias que se le han dado. Por lo tanto, es posible que empiecen a presentar una progresiva negligencia en la higiene bucodental, ya sea porque olvidan la importancia de ésta o incluso porque no recuerdan cómo se usa el cepillo dental o cómo se realiza la limpieza de las prótesis. Esta nueva situación puede desencadenar una serie de problemas odontológicos, que incluyen caries, enfermedad periodontal, halitosis y, finalmente, la destrucción progresiva de los dientes, con las subsiguientes consecuencias sistémicas, incluyendo la dificultad de alimentarse de manera adecuada.
La disminución en los reflejos y la aparición de movimientos involuntarios en la musculatura bucal pueden limitar la función estomatológica. Esto debe tenerse en cuenta, ya que una buena coordinación muscular es fundamental para la estabilidad de cualquier prótesis removible que se intente instalar en un paciente con EA. Del mismo modo, la realización de ciertos procedimientos (como la toma de radiografías y de impresiones) se hace cada vez más difícil a medida que avanza la enfermedad debido a la misma incoordinación motora y al aumento desmedido del reflejo nauseoso.
Estos pacientes pueden ser rehabilitados, aunque es imprescindible que se comprendan sus limitaciones. Por lo tanto, el entrenamiento de personal auxiliar, o de familiares, es fundamental.
También es importante realizar revisiones periódicas de la boca, tanto en aquellos pacientes que aún conserven sus propios dientes como en aquellos que lleven prótesis dentales. Una minuciosa revisión de la cavidad oral puede revelar un pequeño problema antes de que empeore.
Los pacientes con demencia pueden no ser capaces de detectar o explicar que existe un problema. Debemos tener en cuenta algunas pequeñas señales, como la negativa a comer, sobre todo alimentos fríos o calientes, no querer llevar las prótesis dentales, cambios en el sueño, comportamiento agresivo, etc.
McClain propuso en su día que el tratamiento dental debe dividirse en cuatro fases:
• Comunicación con el paciente.
• Historia clínica y exploración oral.
• Programa preventivo.
• Instrucciones de higiene oral para el paciente y el cuidador.
 Las visitas deben ser cortas (puesto que pueden aumentar la ansiedad de los pacientes con demencia) y frecuentes, y los tratamientos simples y enfocados a la prevención y control de la enfermedad bucodental. Asimismo, también propuso aplicar diferentes tratamientos según el estadio en que se encuentre la EA.
Las visitas deben ser cortas (puesto que pueden aumentar la ansiedad de los pacientes con demencia) y frecuentes, y los tratamientos simples y enfocados a la prevención y control de la enfermedad bucodental. Asimismo, también propuso aplicar diferentes tratamientos según el estadio en que se encuentre la EA.
Se ha comprobado que las siguientes medidas preventivas (tabla 1) empleadas en pacientes con demencia son eficaces si se aplican en conjunto con un programa de formación para los cuidadores o familiares:
• Uso de cepillos adaptados y cepillos con succión.
• Uso de cepillos eléctricos.
• Utilización de separadores bucales y utensilios adaptados para facilitar el acceso de los cuidadores al interior de la boca de los pacientes mayores.
• Utilización de productos fluorados.
• Uso de sustitutos salivales.
• Utilización de productos antimicrobianos (clorhexidina).
• Si el paciente lleva prótesis dental parcial, hay que retirarla antes de realizar el cepillado de los dientes.
• Las prótesis dentales parciales o completas deben ser retiradas antes de acostarse y cepillarlas.
• Para evitar daños durante la limpieza, debemos asegurarnos de que el lavamanos está lleno de agua; así evitaremos fracturas si cae la prótesis.
 Manejo odontológico del paciente con deterioro cognitivo
Manejo odontológico del paciente con deterioro cognitivo
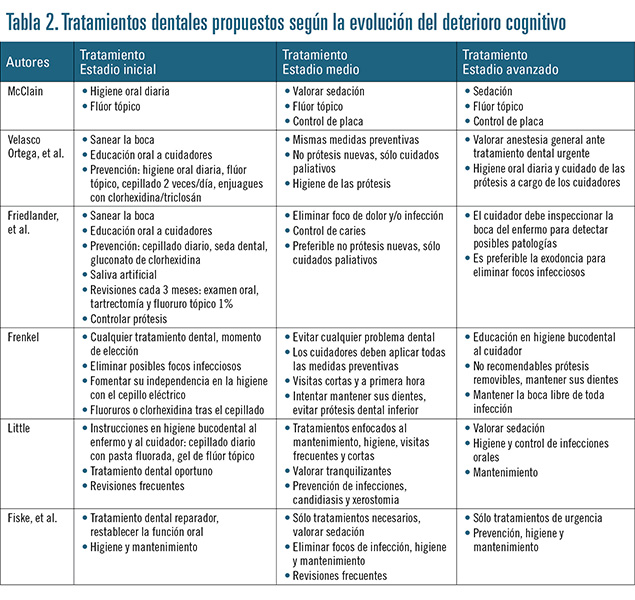
En la tabla 2 se muestran los distintos tratamientos que proponen algunos autores para el manejo odontológico de los pacientes con deterioro cognitivo, así como qué tratamiento es más indicado y en qué estadio de la enfermedad realizarlo.
El comportamiento de las personas mayores dificulta la administración de cuidados por parte de los familiares o cuidadores. Existen técnicas de comunicación y comportamiento que nos ayudan a aumentar el éxito de las intervenciones y a minimizar la «no cooperación». Éstas consisten en:
• Puesta en marcha de una rutina de higiene oral siempre a la misma hora (no es necesario que sea durante el momento de aseo diario).
• Realizar la actividad en un ambiente donde el paciente no tenga distracciones.
• Utilizar frases e indicaciones cortas y sencillas.
• Desglosar las tareas y formular las indicaciones una por una.
• Utilizar la comunicación no verbal.
• Utilizar recordatorios y notas que le ayuden a recordar que debe seguir una higiene bucodental.
• Darle algún objeto que le ayude a mantener las manos ocupadas.
Bibliografía
1. Forman MS, Trojanowski JQ, Lee VM. Neurodegenerative diseases: a decade of discoveries paves the way for therapeutic breakthroughs. Nat Med. 2004; 10: 1.055-1.063.
2. Ship JA. Oral health of patients with Alzheimer´s disease. J Am Dent Assoc. 1992; 123: 53-58.
3. Su H, Gornitsky M, Geng G, Velly AM, Chertkow H, Schipper HM. Diurnal variations in salivary protein carbonyl levels in normal and cognitively in paired human subjects. Age. 2008; 30: 1-9.
4. Friedlander AH, Norman DC, Mahler ME, Norma KM, Yagiela JA. Alzheimer's disease: psychopathology, medical management and dental implications. J Am Dent Assoc. 2006; 137: 1.240-1.251.
5. Syrjälä AM, Ylöstalo P, Sulkava R, Knuuttila M. Relationship between cognitive impairment and oral health: results of the Health 2000 Health Examination Survey in Finland. Acta Odontol Scand. 2007; 65: 103-108.
6. Chalmers JM, Carter KD, Spencer AJ. Caries incidence and increments in community-living older adults with and without dementia. Gerodontology. 2002; 19: 80-94.
7. Ellefsen B, Morse DE, Waldemar G, Holm-Pedersen P. Indicators for root caries in Danish persons with recently diagnosed Alzheimer´s disease. Gerodontology. 2012; 29: 194-202.
8. Warren JJ, Chalmers JM, Levy SM, Blanco VL, Ettinger RL. Oral health of persons with and without dementia attending a geriatric clinic. Spec Care Dentist. 1997; 17: 47-53.
9. Avlund K, Holm-Pedersen P, Morse DE, Viitanen M, Winblad B. Tooth loss and caries prevalence in very old Swedish people: the relationship to cognitive function and functional ability. Gerodontology. 2004; 21: 17-26.
10. Zini A, Sgan-Cohen HD. The effect of oral health on quality of life in an underprivileged homebound and non-homebound elderly population in Jerusalem. J Am Geriatr Soc. 2008; 56: 99-104.
11. Nordenram GL, Ryd-Kjellen E, Johansson G, Nordstrom G, Winblad B. Alzheimer's disease, oral function and nutritional status. Gerodontology. 1996; 13: 9-16.
12. Hatipoglu MG, Kabay SC, Güven G. The clinical evaluation of the oral status in Alzheimer-type dementia patients. Gerodontology. 2011; 28: 302-306.
13. Arrivé E, Letenneur L, Matharan F, Laporte C, Helmer C, Barberger-Gateau P, et al. Oral health condition of French elderly and risk of dementia: a longitudinal cohort study. Community Dent Oral Epidemiol. 2012; 40: 230-238.
14. Syrjälä AM, Ylöstalo P, Ruoppi P, Komulainen K, Hartikainen S, Sulkava R, Knuuttila M. Dementia and oral health among subjects aged 75 years or older. Gerodontology. 2012; 29: 36-42.
15. Machado MC, Lopes GH, Marchini L. Oral health of Alzheimer´s patients in Sao José dos campos, Brazil. Geriatric Gerontol Int. 2012; 12: 265-270.
16. Rejnefelt I, Andersson P, Renver S. Oral health status in individuals with dementia living in special facilities. Int J Dent Hygiene. 2006; 4: 7-71.
17. National Institute for Health and Clinical Excellence. Donepezil, galantimine, rivastigmine and memantine for the treatment of Alzheimer´s disease. 2011. NICE Technology Appraisal Guidance; 217.
18. Departament of Health. Living well with dementia: a National Dementia Strategy. UK Government Department of Health, 2009.
19. Valls C, Molinuevo JL, Rami L. Diagnóstico precoz de la enfermedad de Alzheimer: fase prodrómica y preclínica. Rev Neurol. 2010; 51(8): 4.171-4.480.
20. López OL, McDade E, Riverol M, Becker JT. Evolution of the diagnostic criteria for degenerative and cognitive disorders. Curr Opin Neurol. 2011; 24(6): 532-541.
21. Blennow K, Hampel H. CSF markers for incipient Alzheimer´s disease. Lancet Neurol. 2003; 2: 605-613.
22. Bermejo F, Antequera D, Vargas T, Molina J, Carro E. Saliva levels of Abeta 1-42 as potential biomarker of Alzheimer´s disease: a pilot study. BMC Neurology. 2010; 10: 108.
23. Ray S, Britschgi M, Herbert C, Takeda-Uchimura Y, Boxer A. Classification and prediction of clinical Alzheirmer´s diagnosis base don plasma signaling proteins. Nat Med. 2007; 13: 1.359-1.362.
24. German DC, Gurnani P, Nandi A, Garner HR. Serum biomarkers for Alzheimer´s disease: proteomic discovery. Biomed Pharmacother. 2007; 61: 383-389.
25. Mapstone M, Cheema A, Massimo S, Fiandanca X, Mhyre T, MacArthur L, et al. Plasma phospholipids identify antecedent memory impairment in older adults. Nature Medicine. 2014; 20: 415-418.
26. Lansbury PT. Back to the future: the old-fashioned way to new medications for neurodegeneration. Nat Med. 2004; 10: 51-57.
27. Attems J, Lintner F, Jellinger KA. Olfactory involvement in aging and Alzheimer´s disease: an autopsy study. J Alzheimers Dis. 2005; 7: 149-157.
28. Frederikse PH, Garland D, Zigler JS, Piatigorsky J. Oxidative stress increases production of beta-amyloid precursor protein and beta-amyloid (Abeta) in mammalian lenses, an d Abeta has toxic effects on lens epitelial cells. J Biol Chem. 1996; 271: 10.169-10.174.
29. Fukuchi K, Li L, Hart M , Lindsey JR. Accumulation of amyloid-beta protein in exocrine glands of transgenic mice overexpressing a carboxyl terminal portion of amyloid protein precursor. Int J Exp Pathol. 2000; 81: 231-239.
30. Oh YS, Turner RJ. Effect of gamma-secretase inhibitors on muscarinic receptor-mediated calcium signaling in human salivary epitelial cells. Am J Physiol Cell Physiol. 2006; 291: 76-82.
31. Scheber A, Richter K, Schaps P. Distribution of antiepileptic drugs between plasma, plasma water, cerebrospinal fluid, saliva and brain. Monogr Neural Sci. 1980; 5: 208-212.
32. Sayer R, Law E, Connelly PJ, Breen KC. Association of salivary acetycholinestearase with Alzheimer´s disease and response to cholinesterase inhibitors. Clin Biochem. 2004: 37: 98-104.
33. Ship JA, Puckett SA. Longitudinal study on oral health in subjects with Alzheimer´s disease. J Am Geriatr Soc. 1994; 42: 57-63.
34. Shi M, Sui Y, Peskind E, Li G. Salivary tau species are potential biomarkers os Alzheimer disease. J Alzheimer Dis. 2011; 27(2): 299-305.
35. Pearson A, Chalmers J. Oral hygiene care for adults with dementia in residential aged care facilities JBI Reports. 2004; 2: 65-113.
36. Bridgman AM, Wilson MA. The treatment of adult patients with a mental disability. Part 2: Assessment of competence. British Dental Journal. 2002; 189: 143-146.
37. Kocaelli H, Yaltitrik M, Yargic I, Özbas H. Alzheimer's Disease and dental management. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002; 93: 521-524.
38. Henry RG. Alzheimer's disease and cognitively impaired elderly: providing dental care. J Calif Dent Assoc. 1999; 27: 709-717.
39. Frenkel H. Alzheimer's disease and oral care. Dent Update. 2004; 31(5): 273-278.
40. McClain DL. Dental hygiene care for the Alzheimer's patient. Dental Hygiene. 1987; 61(11): 500-503.
41. Velasco Ortega E, Valencia Alejandre S, Gallardo Castillo I, Vigo Martínez M, Bullón Fernández P. La atención odontológica del paciente con enfermedad de Alzheimer: un enfoque multidisciplinario. Av Odontoestomatol. 1999; 15: 163-173.
42. Little JW. Dental management of patient with Alzheimer's disease. Gen Den. 2005; 53: 289-296.
43. Fiske J, Frenkel H, Griffiths J, Jones V; British Society of Gerodontology; British Society for Disability and Oral Health. Guidelines for the development of local standards of oral health care for people with dementia. Gerodontology. 2006; 23: 5-32.